Биохимия зрительного восприятия света
Биохимия зрительного восприятия света (зрительная фототрансдукция) — зрительный процесс, в котором свет преобразуется в электрохимические сигналы, в клетках палочек, колбочек и фоторецепторах ipRGC сетчатки глаза.[1]
Фототрансдукция в фоторецепторах сетчатки глаза палочках, колбочках и ipRGC — основа формирования оптического изображения в процессе зрения позвоночных животных, при участии сетчатки глаза.[2]
Введение[править | править код]
Формирование оптического изображение в процессе зрения у позвоночных животных связано с находящимися к сетчатке глаза колбочек (cone) и палочек (rod), содержащих фотопигменты опсины (версия Миг), которые под действием света в результате фотохимических реакций способны оппонентно выделять основные биосигналы RGB в мозг. При этом при зрении участвуют фоторецепторы ipRGC, расположенные в сетчатке вне фокальной поверхности в ганглиозном слое сетчатки глаза. Непосредственно они не формируют оптическое изображение, но фоторецепторы ipRGC участвуют в работе колбочек и палочек. Палочки специализированы для «низко-легкого» зрения. Они чрезвычайно чувствительны и могут сигнализировать поглощение одиночных фотонов. Колбочки обеспечивают видения дневного света (иллюстрация 1). Они намного менее чувствительны свету, чем палочки, но обладают более длительным временным восприятия. Они также обеспечивают цветное зрение благодаря наличию нескольких типов колбочек с изменчивыми фотопигментами, чувствительными к различным спектральным лучам.
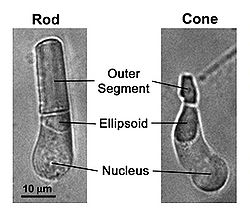
- Рис. 1. Светлопольные изображения фоторецептора палочки и фоторецепторов колбочки, изолированных от сетчатки саламандры. Фототрансдукция имеет место во внешней доле, в то время как эллипсоид плотно упакован mitochondria. Палочки ответственны за тусклое легкое видение, колбочки для видения яркого света.
Имеются большие достижения в понимании фототрансдукции палочки. Начиная с введения электрода всасывания, позволяющего производить запись техники при экспериментах в конце 1970-ых (Baylor и др., 1979a). Фоторецепторы человека, земноводных и относящиеся к млекопитающим (включая примата), могут быть использованы для исследований этим методом. Бычья сетчатка, с другой стороны, была любимой при подготовке к тому, чтобы изучить фототрансдукцию биохимиками из-за изобилия доступной ткани. Мышь, однако, стала более популярной моделью животных для исследования в прошлом десятилетии при помощи появившихся планируемых генных методов. Когда это объединено с электрофизиологией, генетика мыши обеспечивает непревзойденную власть в объяснении в естественных условиях функции ключевых белков фототрансдукции, большинство которых было выбито, сверхвыражено или видоизменено в колбочках, приводя к богатому объему информации на принципах, лежащих в основе увеличения, восстановления и адаптации фотоответов палочек, колбочек. (Таблица 1, рис. 2,3).
Таблица 1. Список главных белков, вовлеченных в палочке мыши и фототрансдукции колбочки, которые были выбиты, сверхвыражены (mutated 1) из-за высокого ограничения.
- При этом не все генетически проектируемые линии мыши перечислены. Для включенных белков только перечислены самые существенные фенотипы (в тексте дано более полное описание);
- Arrestin4 также называют колбочкой-arrestin или X-arrestin (Gurevich и Gurevich, 2006; Никонов и др., 2008);
- Сверхвыражение RGS9‒1 было достигнуто сверхвыражением R9AP, которое привело к сверхвыражению всех трех компонентов комплекса ПРОМЕЖУТКА, RGS9‒1, G_5-L и R9AP.
В описании сначала даны структуры и развитие фоторецепторов мыши, сопровождаемых резюме недавних исследований фототрансдукции палочки с акцентом на информацию, подбираемой от образцов мыши. В конце — упомянут недавний прогресс в обучающихся колбочках мыши.[5]
Зрительный цикл[править | править код]
Зрительный цикл — биологическое преобразование фотона в электрический сигнал в сетчатке. Этот процесс происходит через G-белки «G-протеины» en:G-protein_coupled_receptor, названные опсином, которые содержат хромофор en:11-cis_retinal цис-ретиналь, ковалентно связанный с опсиновым рецептором через основу Schiff — формирование retinylidene белка. Под действием фотона, цис-ретиналь en:11-cis_retinal подвергается фотоизомеризацией en:Photoisomerization в «относящимся к сетчатке глаза всех-сделкок»en:All-trans_retinal, которая изменяет строение опсина GPCR en:GPCR, что приводит к началу каскадов переноса (фототрансдукции) en:Signal_transduction, которые вызывают закрытие циклического канала катиона «GATED» и гиперполяризацию клетки фоторецептора.
Следующая изомеризация и выпуск от opsin белка, «относящаяся к сетчатке глаза вся-сделка»en:All-trans_retinal уменьшена до ретинолаen:Retinol «всей-сделки» и сигнал рефлекторно отправляется назад к относящемуся к сетчатке глаза эпителию пигмента en:Retinal_pigment_epithelium, который «перезаряжается». Это — первый esterified en:Ester ретинола лецитина acyltransferase (LRAT) en:LRAT и затем преобразованный к ретинолу en:Rhodopsin с 11 СНГ isomerohydrolase RPE65 en:RPE65. Isomerase процессы RPE65 показали, но все еще неуверенно, что действует ли это также как гидролаза. Но это окислено в «11 СНГ», относящееся к сетчатке глаза en:11-cis_retinal перед путешествием назад к внешней доле мембраны палочки, где это может снова восстановить (opsin) опсины (версия Миг) для формирования нового, функционального визуального пигмента (rhodopsin) родопсина.
Фоторецепторы[править | править код]
Процесс фототрансдукции — сложный, и чтобы понять его, нужно иметь представление о структуре ячеек фоторецептора, вовлеченных в зрительный процесс, представление о палочках и колбочках. Эти клетки содержат хромофор, (11-cis-retinal, альдегид Витамина A1 en:Vitamin_a) обязанный белку клеточной мембраны опсину. Палочки имеют дело со слабым освещением (низким легким уровнем) и не добиваются цветного видения. Колбочки, с другой стороны, могут закодировать цвет изображения через сравнение продукции трех различных типов колбочек. Каждая колбочка лучше всего отвечает на определенные длины волны, или цвета, света, сфокусированные на них, потому что каждый тип имеет опсин, способный видоизменяться в зависимости от длины волны света. Три типа разновидностей колбочек — L-колбочки, М — колбочки и Булочки (S-колбочки) оптимально отвечают на длинные длины волны (красноватый цвет), средние длины волны (зеленоватый цвет), и на короткие длины волны (синеватый цвет) соответственно.
Процесс[править | править код]
Чтобы понимать поведение фоторецептора в определении (intensities) интенсивности его работы, необходимо понять роли различных потоков.
Есть продолжающийся поток калия, направленный наружу через nongated K+ — отборные каналы. Этот поток направлен наружу и имеет тенденцию гиперполяризовать фоторецептор в пределах — 70 милливольтов (потенциал равновесия для K+).
Есть также внутренний поток натрия, который несут cGMP-gated каналы натрия. Этот так называемый темный поток деполяризует ячейку приблизительно до 40 милливольт. Отметьте, что это значительно более деполяризовано, чем большинство других нейронов.
Высокая плотность «Na+ — K+» насосов позволяют фоторецептору поддержать устойчивую внутриклеточную концентрацию Na+ и K+.
В темноте[править | править код]
Ячейки фоторецептора — не обычные ячейки, потому что они деполяризованы в темноте, то есть свет гиперполяризует и выключает эти ячейки и это роль света — как выключающий выключающиея ячейки, и который активизирует следующую ячейку — полученный возбужлённый сигнал посылается вниз нервной тропы.
В темноте, cGMP уровни высоки и держат cGMP-gated каналы натрия открытым с позволением устойчивого внутреннего потока, названного темным потоком. Этот темный поток держит ячейку деполяризованной приблизительно в 40 милливольтах.
Деполяризация мембраны ячейки открывает каналы кальция напряжения-gated. Увеличенная внутриклеточная концентрация приблизительно при концентрации Ca2+ пузырьков en:Synaptic_vesicle является причиной того, что пузырьки, содержащие специальные химикалии, названные медиаторами en:Neurotransmitters служат, чтобы слиться с мембраной ячейки выпуская медиатор в синаптическую расщелину en:Synaptic_cleft, область между концом одной ячейки и начала другого нейрона en:Neuron. Освобожденный медиатор — глутамат en:Glutamate, медиатор, фоторецепторы от которого бывают часто возбуждёнными.
В глутамате тропы конуса выполняют:
- Гиперполяризацию на-центре биполярных ячеек en:Bipolar_cells. Глутамат, который выпущен от фоторецепторов в темноте, связывает с metabotropic при помощи глутаматных рецепторов (mGluR6) en:Metabotropic_glutamate_receptor_6, который, через механизм сцепления "Белка г ", заставляет неопределенные каналы катиона в ячейках закрываться, таким образом гиперполяризуя биполярную ячейку.
- Деполяризацию биполярных ячеек вне центра. Закрепление глутамата на ionotropic глутаматные рецепторы приводит к внутреннему потоку катиона, который деполяризует биполярную ячейку.
На свету[править | править код]
Если сигнал воспринимается мембранными фоторецепторов, то схему передачи информации на свету можно представить так:

*Шаг 1: фотон Инцидента (hν) поглощен и активизирует родопсин (версия Миг) конформационным изменением в дисковой мембране к R*.
*Шаг 2: Затем, R* устанавливает повторенные контакты с transducin молекулами, катализируя его активацию к G*. выпуском связанного валового внутреннего продукта в обмен на цитоплазматический GTP. α и γ.
*Шаг подединиц 3: G* связывает запрещающие γ подединицы phosphodiesterase (PDE) формирование его α и β подединиц.
*Шаг 4: Активизированный PDE гидролизирует cGMP.
*Шаг 5: циклаза (GC) Guanylyl (СБОРЩИК МУСОРА) синтезирует cGMP, второй посыльный в каскаде фототрансдукции. Уменьшенные уровни цитозольного cGMP заставляют циклический нуклеотид gated каналы закрывать предотвращение дальнейшего притока Na + и Ca2 +.
- 1) Легкий фотон взаимодействует с относящимся к сетчатке глаза мембраной фоторецептора. Он подвергается isomerisation (процесс, в котором одна молекула превращается в другую молекулу, которая имеет точно такие же атомы, но атомы имеют другой механизм, например, A-B-C → B-A-C (эти связанные молекулы называются изомерами), изменяющимеся от 11 СНГ до конфигурации всех-сделок.
- 2) Относящийся к сетчатке глаза участок больше не вписывается с opsinом как обязательный участок.
- 3) Opsin поэтому подвергается от конформационного изменения до metarhodopsin II.
- 4) Метарходопсин II непостоянен и расколы, уступая opsinу и относящимся ко всем сделкам сетчатки глаза .
- 5) opsin активизирует регулирующий белок transducin. Это заставляет transducin отделять от его связанного с ним валового внутреннего продукта, и связывать GTP, тогда как алфавитная подединица transducinа отделяет от беты и гамма подединиц GTP, которые все еще обязанны алфавитной подединице.
- 6) Алфавитный комплекс подединицы-GTP активизирует phosphodiesterase.
- 7) Phosphodiesterase ломает cGMP к 5 '-GMP. Это понижает концентрацию cGMP и поэтому каналы натрия близки.
- 8) Закрытие каналов натрия вызывает гиперполяризацию ячейки из-за продолжающегося потока калия.
- 9) Гиперполяризация ячейки заставляет каналы кальция напряжения-gated закрываться.
- 10)Уровень кальция в снижениях ячейки фоторецептора также понижает количество глутамата (глутаминовая кислота в составе белков) медиатора, который выпущен ячейкой. Это потому, что кальций требуется для содержания глутаматом пузырьков, чтобы соединиться с мембраной ячейки и выпустить их содержание.
- 11) Уменьшение количества глутамата, выпущенного фоторецепторами, вызывает деполяризацию На биполярных ячейках центра (палочка и колбочка «На биполярных ячейках»), и гиперполяризации огораживают биполярные ячейки дорожными конусами.
Дезактивация каскада фототрансдукции[править | править код]
GTPase (Activating Protein (GAP)) — участвует в формировании «Белка (ПРОМЕЖУТОК)» взаимодействуя с алфавитной подъединицей transducin, и заставляет это гидролизировать его со связанным GTP с общеим внутренним содержанием, и таким образом останавливает действие phosphodiesterase, останавливая преобразование cGMP к «В».
Циклаза Guanylate, активизирующая белок (GCAP), где кальций обязательный белок, и поскольку уровни кальция в ячейке уменьшились, GCAP отделяет обязательный белок от его связанных ионов кальция, и взаимодействует с гуанилат-циклазой, активизируя её. Гуанилат-циклаза в таком случае продолжает преобразовывать GTP к состоянию cGMP, пополняя cGMP-ом уровни ячейки и таким образом повторно открывает каналы натрия, которые были закрыты в течение фототрансдукции.
Наконец, Метарходопсин II дезактивирован. Recoverin, другой кальций обязательный белок, является обычно обязанным к Киназе Rhodopsin, когда кальций присутствует. Когда идёт падение уровней кальция в течение фототрансдукции, кальций отделяется от recoverin, и rhodopsin киназа выпускается при переходе к фосфорилату metarhodopsin II, уменьшая его близость к transducin. Наконец, arrestin, другой белок, связывает phosphorylated metarhodopsin II, полностью дезактивируя это. Таким образом, наконец, фототрансдукция дезактивирована, и темный текущий и глутаматный выпуск восстановлен. Это — тропа, где Метарходопсин II — phosphorylated и обязанный arrestin-у таким образом дезактивировать phosphorylated, который, как думают, является ответственным за компонент S2 адаптации к темноте. Компонент S2 представляет линейную секцию подарка функции адаптации к темноте в начале адаптации к темноте для всего отбеливания intensities.
Относящаяся к сетчатке глаза «все-сделки» транспортируют к пигменту эпителиальные ячейки, которые будут уменьшены до ретинола всех-сделок, до «предшественника сетчатки глаза 11 СНГ». И тогда это транспортируется назад к палочкам. Ретинол со всеми-сделками не может синтезироваться людьми и должен поставляться витамином А в диете. Дефицит ретинола во всех всех-сделках может привести к вечерней слепоте. Это — часть отбеливания и перерабатка en:Bleach_and_recycle процесса retinoids в фоторецепторах и относится к сетчатке глаза — эпителию пигмента.
Модель фототрансдукции колбочки мыши[править | править код]
Недавно были достигуты существенные успехи в понимании фототрансдукции колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Однако, несмотря на огромный успех в изучении фототрансдукции палочки за счёт комбинации генетики мыши и электрода всасывания, делающего запись в исследованиях последних лет при использование мыши. Это образцовая система для того, чтобы изучать фототрансдукцию колбочки, была до недавнего времени ограничена исследованиями ЭРГА. Это из-за того, что процент колбочек в сетчатке мал (~3 %) и имеется небольшая долговечность внешней доли (мембраны) (САЛАТ РОМЭН).
Это препятствие было, наконец, преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и не допускает более хрупким САЛАТОМ РОМЭН хорошо вовлекать ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ») фоторецептора колбочки, относящейся к сетчатке глаза, к пластине мембраны, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981), что ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % содержанием их в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый вид испытывает недостаток в нервном лейциновом факторе транскрипции застежки — молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу ячейки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй EGFP экспрессов в колбочках мыши, который облегчает/проверяет их идентификацию (Fei и Hughes, 2001).
- Третий испытывает недостаток в палочке transducin-а α-subunit (gnat1-/-), который блокирует фототрансдукцию прута (Calvert и др., 2000).
- Иллюстрация 16. Ответы вспышки фоторецепторов конуса мыши от различных генотипов a). Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм и М. колбочек при вспышках с 510 нм b). Сравнение средних ответов вспышки на вспышки с 361 нм дикого типа S-cones, gnat1-/- Булочки, Nrl-/- колбочки, и палочки, зарегистрированы под тем же самым «РТОМ» условием. Каждый след измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) с разрешением использования из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, требуется фоновый свет, чтобы подавить ответ палочки так, чтобы ответ колбочки мог быть изолирован. В результате ответ колбочки немного приспособлен к свету, поэтому немного более быстр и меньший для данной интенсивности испытательной вспышки, чем это от gnat1-/- или Nrl-/- колбочек. Когда этот фактор учтен, легкие свойства ответа колбочек мыши, зарегистрированы от трех mouselines и очень подобны и как ожидается относятся к колбочкам млекопитающих (иллюстрация 16, Стол 3) (Никонов и др., 2006). Замечено среди этих особенностей та, что колбочки мыши намного более терпимы, чем палочки мыши к обесцвеченному пигменту. Темный поток оправляется существенно в обоих колбочках типа S-и (синих) M (зелёных) после сильных вспышек, которые отбеливают существенную фракцию пигмента. Однако, одно обнаружение удивляет, что инактивация М. (зелёного) пигмента более задержана, чем от того пигмента S (синего) в отсутствии GRK1, где предлагается существование GRK1-независимого механизма инактивации для пигмента S. Nrl-/- колбочки отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/- колбочки показывают намного более высокий процент содержания S-opsin-а. Таким образом, трансгенные мыши, выражающие EGFP в их колбочках и gnat1-/- мыши лучше, чем Nrl-/- мыши для того, чтобы изучать физиологию колбочек.
. (Где: S-cone - синие колбочки, M-cone — зелёные колбочки, Rods — бесцветные палочки). (См. также Иллюстрацию 16).
- Таблица 3. Динамика и параметры чувствительности палочек и колбочек мыши 1.
См. также[править | править код]
Примечания[править | править код]
- ↑ http://en.wikipedia.org/w/index.php?title=Visual_phototransduction&action=edit§ion=7
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
Литература[править | править код]
- Moiseyev G, Chen Y, Takahashi Y, Wu BX, Ma JX. RPE65 is the isomerohydrolase in the retinoid visual cycle. Proc. Nat. Acad. Sci. 2005 Article. [1]
- Jin M, Li S, Moghrabi WN, Sun H, Travis GH. Rpe65 is the retinoid isomerase in bovine retinal pigment epithelium. Cell. 2005 Article.[2]
Внешние связи[править | править код]
- Visual pigments and visual transduction at med.utah.edu [3]
- A General Overview on Visual Perception at brynmawr.edu [4]
- MeSH Phototransduction [5]
- перенаправление шаблон:цвета радуги
| Цвета и оттенки | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 |
|  | |||||||||||||||||||||||||||||||||||
| ∘ ∘ ∘ | |||||||||||||||||||||||||||||||||||||