Идентификация разновидностей йодопсина — цианолаба
Фотопигменты Опсины (версия Миг) — G-белки фотосинтеза и зрения. Опсины пигменты группы рецепторных белков семейства ретинолидов с молекулярной массой 35‒55 кДа, связанных с мембраной G-протеинов (G protein-coupled). Обнаружены в мембране галобактерий, в светочувствительных фоторецепторных клетках беспозвоночных и позвоночных животных (сетчатка (версия Миг)), фотосинтезирующих организмах, в светочувствительном пигменте меланофоров кожи земноводных, радужке лягушки и т. д.
Разновидность опсинов содержит четыре группы фотопигментов колбочек, участвующих в цветном зрении:
- Четыре типа опсинов колбочек (фотопсины) — экспрессируются в колбочках, участвующих в цветном зрении с общим названием йодопсины:
- Чувствительные в области длинных волн (Long Wavelength Sensitive, LWS, OPN1LW) опсины — λmax в красном диапазоне
- Чувствительные в области волн средней длины (Middle Wavelength Sensitive, RH2 или MWS) опсины — λmax в зеленой части спектра
- Чувствительные в области коротких волн 2 (SWS2) опсины — λmax в синем диапазоне
- Чувствительные в области коротких волн 1 (SWS1) опсины — λmax в фиолетовой и ультрафиолетовой части диапазона
В области длинных и средних (красный и зелёный диапазон) волн фотопигменты колбочек обнаружены.
В области коротких волн предполагаемый фотопигмент цианолаб пока не обнаружен, но индентифицирован.
Виды фотопигментов колбочек[править | править код]
Различные опсины (версия Миг) отличаются аминокислотами в составе молекул, и поглощают свет в несколько различном диапазоне длин волн, как ретиналь-связанные молекулы.
У человека идентифицировано три вида йодопсина (фотопсина):
- 560 nm: rot-sensitives L-Iodopsin mit L-Photopsin, Шаблон:UniProt. Defekte am OPN1LW-Gen sind die Ursache der Protanopie — красные лучи света;
- 530 nm: grün-sensitives M-Iodopsin mit M-Photopsin, Шаблон:UniProt. Defekte am OPN1MW-Gen sind die Ursache der Deuteranopie — зелёные лучи света;
- 420 nm: blau-sensitives S-Iodopsin mit S-Photopsin, Шаблон:UniProt. Defekte am OPN1SW-Gen sind die Ursache der Tritanopie — синие лучи света. Открытие колбочек-S связано с наличием у них не открытого синего фотопигмента цианолаба.
| Cone type | Name | Range | Peak wavelength[1][2] |
|---|---|---|---|
| S (OPN1SW) — «tritan», «cyanolabe» | β | 400—500 nm | 420‒440 nm |
| M (OPN1MW) — «deutan», «chlorolabe» | γ | 450—630 nm | 534‒545 nm |
| L (OPN1LW) — «protan», «erythrolabe» | ρ | 500—700 nm | 564‒580 nm |
Введение[править | править код]

Важная работа Уолда.[4] о применении интенсивного адаптирующего жёлтого, пурпурного и синего фона, позволило Уолду получить три разные пороговые кривые. Делая поправку на поглощение в передних средах глаза (хрусталик и жёлтый макулярный пигмент), Уолд называет в качестве максимумов трёх «приёмников» (он обнаружил не приёмники, а только максимумы поглощения тканями сетчатки, хотя тканями сетчатки впоследствии оказались приёмники — фоторецепторы сетчатки колбочки) 430, 540 и 575 нм.[5]
На рис. 1. Кривые спектральной чувствительности пигментов глаза нормального трихромата, определённые колориметрическим методом (А), и спектры поглощения, но измеренные в наружных сегментах одиночных экстерорецепторов колбочек макаки (Б).(По. Marks et al., 1964). Сплошные кривые на А представляют результат расчёта кривых спектральной чувствительности по кривым сложения нормального трихромата (Бонгард, Смирнов, 1955); кружки — результаты опытов с дихроматами [6]
Индентификация фотопигментов опсинов фоторецепторов животных[править | править код]
Недавно были опубликованы работы в которых были предложены возможные механизмы трансдукции колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Однако, несмотря на изучение фототрансдукции палочки за счёт комбинации генетики мыши и микро электродов, позволяющих делать запись нервных импульсов на примерах сетчатки мыши, была до недавнего времени ограничена исследованиями ЭРГА. Это связано с тем, что процент колбочек в сетчатке мал (~3 %) и недолговечность внешней доли (мембраны) (САЛАТ РОМЭН).
Это препятствие было, наконец, преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и при этом не допускался более хрупкий «САЛАТ РОМЭН», который мог обеспечивать условия хорошего вовлечения ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ») фоторецептора колбочки, относящейся к сетчатке глаза мембранной пластины, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981) как ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый вид испытывает недостаток в нервном лейциновом факторе транскрипции застежки — молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу клетки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй EGFP экспрессов в кодбочках мыши, который облегчает/проверяет их идентификацию (Fei и Hughes, 2001).
- Третий испытывает недостаток в палочке transducin α-subunit (gnat1-/-), который блокирует фототрансдукцию прута (Calvert и др., 2000).
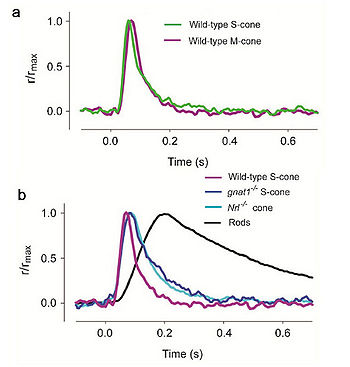
- Иллюстрация 16. Ответы вспышки фоторецепторов кобочек мыши от различных генотипов. a. Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм и М. колбочек при вспышках с 510 нм (b). Сравнение средних ответов вспышки на вспышки с 361 нм дикого типа S-колбочек, gnat1-/- или Nrl-/- колбочки, и палочки, зарегистрированные под тем же самым «РТОМ» условии. Каждый след измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) опубликованы с разрешением из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, фоновый свет подбирался таким, чтобы подавить ответ палочки, и чтобы ответ колбочки мог быть изолирован. В результате ответ колбочки немного приспособлен подбором света, и поэтому был немного более быстр и меньшим для данной интенсивности испытательной вспышки, чем это от gnat1-/- или Nrl-/- колбочки. Когда этот фактор был учтен, легкие свойства ответа колбочек мыши, зарегистрированных от трех mouselines, очень подобны и как ожидалось они относятся к колбочкам млекопитающих (иллюстрация 16, Стол 3) (Никонов и др., 2006). Видно, что среди этих особенностей — то, что колбочки мыши намного более терпимы, чем палочки мыши к обесцвеченному пигменту. Темный поток света (меньшая освещённость) воспринимается более существенно в обоих колбочках типа S и M. после воздействия сильных лучей вспышек, которые отбеливают существенную фракцию фотопигмента. Однако, одно обнаруженное удивление состоит в том, что инактивация М. пигмента более задержана, чем от от пигмента S в отсутствии GRK1, предлагая существование GRK1-независимого механизма инактивации для пигмента S.(синего) Nrl-/- колбочки отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/- колбочки выражают намного более высокий процент активности от S-opsin. Таким образом, трансгенные мыши, выражающие EGFP в их колбочках и gnat1-/- мыши лучше, чем Nrl-/- мыши для того, чтобы изучать физиологию колбочки. Таким образом получена зависимость активности трансгенных колбочек и диких в зависимости от разновидности пигмента кон-опсина, и следовательно имеется связь между видом колбочек S,M,L и видом пигмента в каждой из них! (Необходимое замечание).
- Таблица 3. Динамика и параметры чувствительности палочек и колбочек мыши 1.
Денситометрия при нахождении фотопигментов колбочек[править | править код]
Йодопсин — общее название зрительных пигментов колбочек сетчатки, участвующих в механизме цветного зрения.
История[править | править код]
Впервые существование колбочкого пигмента (косвенным образом) было обнаружено Уолдом, который и дал ему название йодопсин..[9] В 1967 г. за эти работы ему была присуждена Нобелевская премия по физиологии и медицине.
Работа Уолда.[10] Применение интенсивного адаптирующего жёлтого, пурпурного и синего фона, позволило Уолду получить три разные пороговые кривые. С учётом поправок на поглощение в передних средах глаза (хрусталик и жёлтый макулярный пигмент), Уолд фиксирует максимумы трёх «приёмников» (хотя реально он обнаружил не приёмники, а только максимумы поглощения тканями сетчатки) 430, 540 и 575 нм.,[11] где как оказалось впоследствии, максимум 430нм — показатель длины волны синей колбочки, которую, обнаружили учёные Лаборатории Р. Е. Марка, например, Доктор Kalloniatis теперь Роберт г. Leitl профессор Оптометрии кафедры Оптометрии и Видение Науки, университет Auckland[12] (См. Визуальное цветное зрение (версия Миг)).
Первые попытки найти три пигмента и, как предполагалось три типа колбочек проводились Раштоном,[13] который довёл до совершенства методику Денситометрии для прижизненного измерения коэффициентов поглощения света с различной длиной волны — в слое фоторецепторов сетчатки. Было показано, что у цветоаномалов отсутствует один из пигментов, имеющихся у людей с нормальным зрением: «эритролаб» (максимум около 585 нм.) у протанопа и «хлоролаб» (максимум около 540 нм.) — у дейтеранопа.
Современные методы исследований фотопигментов колбочек[править | править код]
Денситометрия клеток сетчатки глаза[править | править код]
Например, в медицине в общей и дифференциальной диагностике, при патологии и лечении различных заболеваний зрительной системы, используются разнообразные электрофизиологические методы исследования — ЭРГ. Выбор метода определяется происхождением биоэлектрической активности в пигментном эпителии, тех или иных слоях и нейронах сетчатки, центральном отделе зрительного анализатора зрительной коры.
Определение состояния вообще или локализации заболеваний, когда проводят электрофизиологическое (ЭОГ, dc ЭРГ, с-волна) тестирование методом денситометрии, может быть следующей:
- Пигментный эпителий сетчатки (ЭОГ, dc ЭРГ, с-волна);
- Наружный сегмент фоторецепторов (мембраны колбочек, палочек)(ранний, рецепторный потенциал — денситометрия), определение способности выделять сфокусированные лучи предметной точки колбочками и палочками (КЗС),
- рецепторный слой (а-волна в общей ЭРГ),
- колбочковая система (фотопическая ЭРГ, тесты на цветовое зрение, мелькающая ЭРГ),
- палочковая система (палочковая изолированная ЭРГ на слабый голубой или белый стимул ниже колбочкового порога, тесты на темновую адаптацию),
- средние слои сетчатки, клетки Мюллера (b-волна общей ЭРГ), *амакриновые и биполярные клетки (осцилляторные потенциалы, Р50-компонент паттерн-ЭРГ, порог негативного ответа);
- слой ганглиозных клеток сетчатки (паттерн ЭРГ), макулярная область (локальная, макулярная ЭРГ);
- зрительный тракт (зрительные вызванные корковые потенциалы).[14]
Если первые попытки найти три пигмента и, как предполагалось три типа колбочек проводились Раштоном,[15] который довёл до совершенства методику Денситометрии для измерения коэффициентов поглощения света с различной длиной волны — в слое фоторецепторов сетчатки и было показано, что у цветоаномалов отсутствует один из пигментов, имеющихся у людей с нормальным зрением: «эритролаб» (максимум около 585 нм.) у протанопа и «хлоролаб» (максимум около 540 нм.) — у дейтеранопа, то сейчас при помощи специальных методов динстометрии с применением современных денситометров учёным удаётся определить работу колбочек и палочек в состоянии нормальной деятельности и диагностике их заболеваний.[16]
См. также[править | править код]
Примечания[править | править код]
- ↑ Günther Wyszecki Color Science: Concepts and Methods, Quantitative Data and Formulae. — 2nd. — New York: Wiley Series in Pure and Applied Optics, 1982. — ISBN 0-471-02106-7о книге
- ↑ The Reproduction of Colour. — 6th. — Chichester UK: Wiley–IS&T Series in Imaging Science and Technology, 2004. — С. 11–12. — ISBN 0-470-02425-9о книге
- ↑ Нюберг Н. Д., Юстова Е. Н., 1955. Тр. Гос. оптич. инст., 24 : 33.
- ↑ Wald G. 1964. Science, 144 : 1007.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Гл. 11, Цветовое зрение, Стр. 246—258
- ↑ Нюберг Н. Д., Юстова Е. Н., 1955. Тр. Гос. оптич. инст., 24 : 33.
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ Wald G., The photochemistry of vision, Doc. Ophthalmol., 3, 94 (1949)
- ↑ Wald G. 1964. Science, 144 : 1007.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Гл. 11, Цветовое зрение, Стр. 246—258
- ↑ http://webvision.med.utah.edu/book/part-viii-gabac-receptors/color-perception/
- ↑ Rushton W. A. H. 1958. In: Visual problems of colour. N. P. L. Sump. No 8, 1, Teddington : 73.
- ↑ http://glazamed.ru/iss/5.1.5.php
- ↑ Rushton W. A. H. 1958. In: Visual problems of colour. N. P. L. Sump. No 8, 1, Teddington : 73.
- ↑ http://glazamed.ru/iss/5.1.5.php