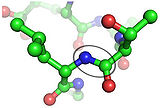
Механизмы зрительных процессов с участием опсинов
Данная статья отражает видение функционирования принципа цветовосприятия только с точки зрения отдельного пользователя - Миг (сама статья, орфография и стилистика автора сохранены).
Механизмы зрительных процессов с участием опсинов отличающиеся кратким описанием структуры и развития фоторецепторов мыши, сопровождаемых данными и резумье недавних исследований фототрансдукции палочки с акцентом на информацию, собираемой от образцов мыши и недавним прогрессом в индентификации колбочек на примере обучающихся колбочек трансгенных и диких мышей.
Структура палочек и колбочек[править | править код]
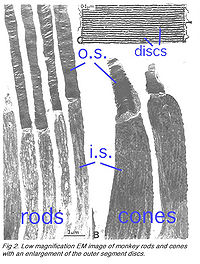
Палочки составляют ~97 % фоторецепторов сетчатки глаза мыши, колбочки — остальное (Картер-Доусон и LaVail, 1979). Методика измерений параметров клеток фоторецепторов мыши как и фоторецепторов приматов аналогична (Стол 2 и иллюстрация 2) . Внешняя доля — приблизительно в диаметре 1.4мкм и 24мкм в длину для палочек, и, соответственно, приблизительно 1.2мкм и 13мкм для колбочек. Эти величины являются значительно меньшими, чем у фоторецепторов земноводных (иллюстрация 1), которые объясняют давнюю пользу физиологов для исследований последних.

- Таблица 2. Физические измерения внешней доли палочек мыши и колбочек Саламандры, а фоторецепторы примата включены для сравнения.
Палочки и колбочки имеют четыре первичных структурных/функциональных областей: внешняя доля, внутренняя доля, тело ячейки и синаптический терминал. Внешняя доля связана с внутренней долей через тонкую соединительную ресницу. Внешняя доля является заполненной плотным прозрачным веществом мембранных дисков (иллюстрации 2 и 3), разделённой промежутками в приблизительно в 28 нм. Диски несут визуальный пигмент (rhodopsin в палочках и разновидности пигментов колбочки в колбочках) и других компонентах трансдукции или как трансмембранные или периферийные мембранные белки (иллюстрация 3). Визуальный фотопигмент — самый насыщенный белок во внешней доле (мембране). Важность визуального пигмента как главного структурного компонента демонстрируется у мыши rhodopsin-нокаута, палочке, внешние доли которой не в состоянии сформироваться (Humphries и др., 1997; Лем и др., 1999). Фоторецепторы палочки этой мыши — выродившийся сопровождаемый представитель колбочек. Упаковочная плотность молекул пигмента на дисках необычно однородна поперек различных позвоночных разновидностей, содержашихся на площади ~25000 мм², соответствуя концентрации ~ 3mM (Harosi, 1975). Общее количество молекул пигмента во внешней доле может таким образом быть вычислено примерно от ее объема конверта. Плотный стек дисков очень увеличивает вероятность захвата фотона. Интересное различие между палочками и колбочками — это то, что диски палочки(за исключением возникающих дисков в основе внешней доли) полностью усвоены и поэтому физически отдельные от плазменной мембраны, тогда как диски колбочки остаются свёрнутыми плазменной мембраной. Открытые диски колбочки предлагают намного большую поверхностную область для быстрых потоков веществ между внешностью клетки и интерьером, по типу передачи хромофора для регенерации фотопигмента и быстрой динамики кальция в течение световой адаптации.
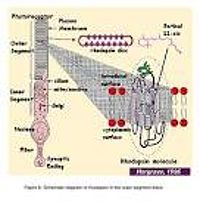
- Рис. 2. Слабое усиление изображений (малая светочувствительность) палочек и колбочек обезьяны с расширением внешних дисков (мембран) доли.
- Рис.3. Схематическая диаграмма rhodopsin во внешних дисках (мембран) доли.
Внутренняя доля фоторецепторов содержит endoplasmic сеточку и аппарат Golgi. Это также упаковано mitochondria, близко, смежно с внешней долей (иллюстрации 2 и 3), чтобы обеспечить высокий спрос на метаболическую энергию, связанную с фототрансдукцией. Все белки, предназначенные для внешней доли, должны пройти через узкую зону соединительной ресницы между внешним и внутренними долями.
Синаптический терминал передает световой сигнал к нейронам второго уровня в сетчатке: к биполярным и горизонтальным клеткам. В темноте есть устойчивый внутренний поток («темный поток») через проводимость катиона на мембране внешней доли (Hagins и др., 1970), деполяризуя палочку или колбочку и поддерживая устойчивый синаптический выпуск глутамата. Свет закрывает эту проводимость катиона («светочувствительная» проводимость, состоя из cGMP-gated каналов) служит, чтобы остановить темный поток и произвести мембранную гиперполяризацию как ответ. Эта гиперполяризация уменьшает или заканчивает темный глутаматный выпуск. Сигнал далее обработывается другими нейронами в сетчатке прежде, чем передаётся в высшие отделы зрительных центров в мозге.
Зрительные пигменты палочек и колбочек мыши[править | править код]
Некоторые исследователи до сих пор ошибочно считают, что наличие определённого числа опсинов в тканях сетчатки должно означать и существование такого же числа колбочек (видимо исходя из предположения: одна колбочка — один опсин). Подтверждения этой догадке так и не получено. Наоборот доказано, что в колбочке одновременно может находится несколько различных опсинов входящих в состав светочувствительных пигментов. (1964)[4]
Однако, проводятся исследования механизмов цветовосприятия, связанных с существованием различных типов колбочек с различными пигментами, чувствительными к областям спектра S, M., L . Пример такого подхода прослеживается и в работе, посвящённой исследованию сетчатки глаза мыши.
В сетчатке мыши обнаружены единственный пигмент палочки, rhodopsin, и два пигмента колбочек. Авторы предполагают, что пигменты чувствительные к коротковолновой области находятся только в S-(синих) колбочках, а пигменты чувствительные к длинноволновой оласти соответственно в M.-(зелёных) колбочках, с максимальной спектральной чувствительностью в 360 нм и 508 нм, соответственно. Мышь необычна в том индивидуальном составе -S и -М. пигментов колбочек, когда уровень пигмента М колбочки имеет градиент уменьшения от спинной до брюшной части сетчатки (Applebury и др., 2000).
Мышь-rhodopsin и пигменты колбочек принадлежит семье высшего качества соединенных рецепторов Белка г (GPCRs). С высокой разрешающей способностью (2.8 Å) была определена трехмерная структура банка основания бычьего rhodopsin в 2000 Palczewski и др. (иллюстрация 9b) (Palczewski и др., 2000; Stenkamp и др. 2002). Будущий вызов должен решить структуру пигментов колбочки, которые намного более непостоянны, чем единственный пигмент палочки родопсин (rhodopsin).


- Иллюстрация 9. Структурная модель бычьего rhodopsin, показ семи трансмембранных компонентов и участка приложения в сетчатке глаза. Семь ТМ helices показывают пронумерованные серые коробки, и β-strands — берега показывают стрелки. Соответствующие диапазоны остатка этого ТМ helices следующие: я, 35-60; II, 71-100; III, 107—137; IV, 151—173; V, 200—225; VI, 247—277; VII, 286—306; VIII, 310—324. Расплющенная линия указывает двусернистое обязательство C110-C187, расположенное в интерфейсе между областями EC и ТМ. Переизданный от (Rader и др., 2004)
- Иллюстрация 9b. Пара стерео кристаллической структуры rhodopsin. От Stenkamp и др. 2002.
Исследования в области индентификации фоторецепторных опсинов[править | править код]
Недавно были опубликованы работы в которых были предложены возможные механизмы трансдукции колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Однако, несмотря на изучение фототрансдукции палочки за счёт комбинации генетики мыши и микро электродов, позволяющих делать запись нервных импульсов на примерах сетчатки мыши, была до недавнего времени ограничена исследованиями ЭРГА. Это связано с тем, что процент колбочек в сетчатке мал (~3 %) и недолговечность внешней доли (мембраны) (САЛАТ РОМЭН).
Это препятствие было, наконец, преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и при этом не допускался более хрупкий «САЛАТ РОМЭН», который мог обеспечивать условия хорошего вовлечения ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ») фоторецептора колбочки, относящейся к сетчатке глаза мембранной пластины, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981) как ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый вид испытывает недостаток в нервном лейциновом факторе транскрипции застежки — молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу клетки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй EGFP экспрессов в кодбочках мыши, который облегчает/проверяет их идентификацию (Fei и Hughes, 2001).
- Третий испытывает недостаток в палочке transducin α-subunit (gnat1-/-), который блокирует фототрансдукцию прута (Calvert и др., 2000).
- Иллюстрация 16. Ответы вспышки фоторецепторов конуса мыши от различных генотипов. a. Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм и М. колбочек при вспышках с 510 нм (b). Сравнение средних ответов вспышки на вспышки с 361 нм дикого типа S-колбочек, gnat1-/- или Nrl-/- колбочки, и палочки, зарегистрированные под тем же самым «РТОМ» условии. Каждый след измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) опубликованы с разрешением из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, фоновый свет подбирался таким, чтобы подавить ответ палочки, и чтобы ответ колбочки мог быть изолирован. В результате ответ колбочки немного приспособлен подбором света, и поэтому был немного более быстр и меньшим для данной интенсивности испытательной вспышки, чем это от gnat1-/- или Nrl-/- колбочки. Когда этот фактор был учтен, легкие свойства ответа колбочек мыши, зарегистрированных от трех mouselines, очень подобны и как ожидалось они относятся к колбочкам млекопитающих (иллюстрация 16, Стол 3) (Никонов и др., 2006). Видно, что среди этих особенностей — то, что колбочки мыши намного более терпимы, чем палочки мыши к обесцвеченному пигменту. Темный поток света (меньшая освещённость) воспринимается более существенно в обоих колбочках типа S и M. после воздействия сильных лучей вспышек, которые отбеливают существенную фракцию фотопигмента. Однако, одно обнаруженное удивление состоит в том, что инактивация М. пигмента более задержана, чем от от пигмента S в отсутствии GRK1, предлагая существование GRK1-независимого механизма инактивации для пигмента S. Nrl-/- колбочки отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/- колбочки выражают намного более высокий процент активности от S-opsin. Таким образом, трансгенные мыши, выражающие EGFP в их колбочках и gnat1-/- мыши лучше, чем Nrl-/- мыши для того, чтобы изучать физиологию колбочки. Таким образом получена зависимость активности трансгенных колбочек и диких в зависимости от разновидности пигмента кон-опсина, и следовательно имеется связь между видом колбочек S,M,L и видом пигмента в каждой из них!

- Таблица 3. Динамика и параметры чувствительности палочек и колбочек мыши 1.
См. также[править | править код]
Примечания[править | править код]
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ Marks W. B., W. H. Dobelle, E. F. McNichol. 1964. Science, 143 : 1181.
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
Внешние ссылки[править | править код]
- Review of opsins and current research: 10.1098/rstb.2009.0051
- Illustration — иллюстрации с сайта Baldwin-Wallace College
- MeSH Opsin
| Глаз и Зрение | |||
|---|---|---|---|
| Зрение |
Глаз человека • Зрение • Глаз • Бионический глаз человека • Цветное зрение • Воздействие цвета на нервную систему • Эволюция цветного зрения • Бинокулярное зрение • Периферийное зрение • Дневное зрение • Зрение в условиях слабого освещения • Ночное зрение • Зрительная система • Зрительная кора • Зрение человека • Цветное зрение у птиц • Дальтонизм • Фотопигмент • Опсины • Саккада • Зрительные иллюзии • Зелёный луч • Эффект Пуркинье • Эффект Трокслера |     | |
| Анатомия глаза |
| ||
| Теории цветовосприятия |
Теория цветного зрения • Теории цветового зрения • Религиозная гипотеза зрения • Гипотеза М. В. Ломоносова о цветном зрении • Теория цветовосприятия Иоганнеса Мюллера • Теория Юнга - Гельмгольца • Теория Геринга • Психофизическая теория цветоощущения Георга Мюллера • Теория Лэдд-Франклин • Зонная теория Крисса • Теория Кёнинга • Гипотеза Г. Хартриджа • Концепция М. Смирнова • Модель П. Уолравена • Теория цветного зрения Лэнда • Теория многокомпонентного цветного зрения • Трёхкомпонентная теория цветного зрения • Оппонентная теория цветного зрения • Нелинейная теория зрения • | ||
| ∘ Оптика, свет и цвет ∘ | |||