Ядро клетки
Ядро клетки содержит большую часть генетического материала клетки, организованного как множество длинных линейных молекул ДНК в комплексе с большим разнообразием белков, типа гистонов en:Histone, а также сформированные хромосомы. Гены в пределах этих хромосом — ядерный геном клетки. Функция ядра должна поддерживать целостность этих генов и управлять действиями клетки, регулируя генное выражение en:CytoplasmGene_expression — ядро, т.е. центр контроля ячейки. Главные структуры, составляющие ядро — ядерный конверт en:Nuclear_envelope, двойная мембрана, которая ограничивает весь органоид и отделяет его содержание от клеточной цитоплазмы, и ядерной тонкой пластинки en:Nuclear_lamina, meshwork в пределах ядра, которая добавляет механическую поддержку, как цитоскелет, который поддерживает клетку в целом.
Поскольку ядерная мембрана непроницаема для большинства молекул, ядерные поры en:Nuclear_pore позволяют движение молекул поперек конверта. Эти поры пересекают обе из мембран, обеспечивая канал, который позволяет свободное движение маленьких молекул и ионов en:Ion. Движением больших молекул, типа белков, тщательно управляются, и являются активным транспортом, регулируемого белками курьера. Ядерный транспорт en:Nuclear_transport является критическим для функции клетки, поскольку движение через поры требуется и для генного выражения и для хромосомного обслуживания.
Хотя интерьер ядра не содержит никаких направляющихся к мембране подкупе, его содержание не однородно, и множество подъядерных тел существует, составленное из уникальных белков, молекул РНК en:RNA, и специфических частей хромосом. Самые известные из них — nucleolus en:Nucleolus, который главным образом вовлечен на собрании рибосом. Будучи произведенными в nucleolus en:Ribosome, рибосомы экспортируются в цитоплазму, где они переводят mRNA.[1]
История[править | править код]


Ядро было первым органоидом, который был обнаружен. Вероятно самый старый сохраненный рисунок относится ко времени ранней микроскопии фургона Антони Leeuwenhoek (1632 – 1723) en:Antonie_van_Leeuwenhoek. Он наблюдал "Люмен", ядро, в красных кровяных клетках en:Red_blood_cell лосося en:Salmon.[2] В отличие от относящихся к млекопитающим красных кровяных клеток, которые в других позвоночных животных все еще обладают ядрами. Ядро было также описано Францом Бауером в 1804 en:Franz_Bauer[3] и более подробно в 1831 шотландским ботаником Роберт Браун en:Robert_Brown_(botanist) в разговоре в линнеевском Обществе Лондона en:Linnean_Society_of_London. Коричневый цвет орхидеи en:Orchid при изучении под микроскопом, когда он наблюдал непрозрачную область, которую он назвал участком крыла насекомогоили ядром, в ячейках внешнего слоя цветка.[4] Он не предлагал потенциальную функцию. В 1838, Маттиас Шлеиден en:Matthias_Schleiden предложил, чтобы ядро должно играть роль в создании клеток, таким образом, он вводил название "Cytoblast" (строитель ячейки). Он полагал, что наблюдал новые ячейки, собирающиеся вокруг "cytoblasts". Франц Меиен en:Franz_Meyen был сильным противником этого представления, уже описав ячейки, умножающиеся разделением и верящие, что много ячеек не будут иметь никаких ядер. Идея, что ячейки могут быть произведены de novo, "cytoblast" или иначе, противоречила работе Робертом Ремаком (1852) en:Robert_Remak и Радолфом Вирчоу en:Rudolf_Virchow (1855), кто решительно размножал новую парадигму, что клетки произведены исключительно клетками ("Omnis cellula e cellula"). Функция ядра оставалась неясной.[5]
Между 1876 и 1878, Оскар Хертвиг en:Oscar_Hertwig издал несколько исследований оплодотворения en:Fertilization морских en:Sea_urchin яиц пострела, показывая, что ядро спермы en:Sperm входит в ооцит en:Oocyte и соединяется с его ядром. Это было первой попыткой заявить, что человек развивается от (единственной) nucleated ячейки. Это было в противоречии к теории Эрнста Хекеля en:Ernst_Haeckel, что полная филогения en:Phylogeny разновидности будет повторена в течение эмбрионального развития, включая поколение первой nucleated ячейки от "Monerula", бесструктурная масса исконной слизи ("Urschleim"). Поэтому, потребность ядра спермы для оплодотворения была обсуждена в течение достаточно долгого времени. Однако, Хертвиг подтверждал его наблюдение в других группах животных, например, амфибии en:Amphibians и моллюски en:Molluscs. Эдуард Штрасбургер en:Eduard_Strasburger произвел те же самые результаты для заводов (1884). Это проложило путь, который состоял в том, что в качестве основы следует рассматривать ядро, играющего важную роль в наследственности. В 1873, август Weismann en:August_Weismann постулировал эквивалентность материнских и отеческих зародышевых клеток для наследственности. Функция ядра как курьер генетической информации стала ясной только позже, после того, как mitosis en:Mitosis был обнаружен, и Менделевские правила en:Mendelian_inheritance были открыты вновь в начале 20-ого столетия; хромосомная теория наследственности была развита.[6]
Структуры[править | править код]
Ядро — наибольший клеточный органоид en:Organelle у животных.[7] В относящихся к млекопитающим en:Mammal ячейках, средний диаметр ядра — приблизительно 6 мкм, который занимает приблизительно 10 % полного объема ячейки.[8]. Вязкую жидкость в пределах клетки называют нуклеоплазмой (Nucleoplasm) — вещество, образующее клеточное ядро: в живых клетках гомогена или коллоидный раствор белков, окружающих хроматин и ядрышко, [9] en:Nucleoplasm, которая подобна цитозоли en:Cytosol, найденной вне ядра.[10] Это выглядит как плотный, примерно сферический органоид.
Ядерный конверт и поры[править | править код]
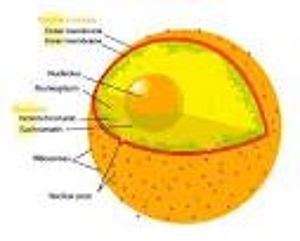

Ядерный конверт en:Nuclear_envelope, иначе известный как ядерная мембрана состоит из двух клеточных мембран en:Cell_membrane, внутренней и внешней мембраны, устроенных параллельно друг другу и отделенных 10 - 50 нм. Ядерный конверт полностью содержит ядро и отделяет генетический материал ячейки от ближайшей цитоплазмы, служа барьером, чтобы препятствовать макромолекулам en:Macromolecule распространяться свободно между nucleoplasm и цитоплазмой.[13]Внешняя ядерная мембрана непрерывна с мембраной грубой endoplasmic сеточки (RER) en:Rough_endoplasmic_reticulum#Rough_endoplasmic_reticulum, и аналогично оббита рибосомами en:Ribosomes. Место между мембранами называют perinuclear местом и непрерывным с люменом RER en:Lumen_(anatomy).
Ядерные поры en:Nuclear_pores, которые обеспечивают водные каналы через конверт, составлены из многократных белков, все вместе называемые nucleoporins. Поры имеют молекулярная масса|молекулярную массу приблизительно 125 миллионов дальтон и состоят из приблизительно от 50 (у дрожжей) en:Yeast до 100 белков (у позвоночных животных). en:Vertebrate[14] Поры - 100 нм (нитрометан) в полном диаметре; однако, промежуток, через который свободно распространяются молекулы, - только приблизительно 9 нм, широких, должных к присутствию регулирующих систем в пределах центра поры. Этот размер позволяет свободный проход маленьких растворимых в воде молекул, предотвращая большие молекулы, типа нуклеиновых кислот en:Nucleic_acid и больших белков, от несоответствующего входа или перехода из ядра. Эти большие молекулы должны активно транспортироваться в ядро вместо этого. Ядро типичной относящейся к млекопитающим клетки будет иметь приблизительно 3000 - 4000 пор всюду по ее конверту,[15]каждый из которых содержит имеющую форму пончика, восьмикратно-симметричную кольцевую структуру в положении, где внутренние и внешние мембраны соединяются.[16]Приложенная к кольцу структура, названная ядерной корзиной, которая простирается в нуклеоплазму, и ряд волокнистых расширений, которые достигают цитоплазмы. Обе структуры служат, чтобы добиться закрепления с ядерными транспортными белками.[17]
Большинство белков, рибосомные субъединицы, и некоторые РНК транспортируются через комплексы пор в процессе, установленном семьей транспортных факторов, известных как karyopherins. Те karyopherins, которые добиваются движения в ядро, также называют importins, тогда как те, которые добиваются движения из ядра, называют exportins. Большинство karyopherins взаимодействует непосредственно с их грузом, хотя используютс некоторые белки адаптера.[18]Гормоны стероида en:Steroid_hormone, типа кортизола en:Cortisol и альдостерона, en:Aldosterone так же как других маленьких разрешимых липидом молекул, вовлеченных в межклеточную передачу сигналов ! en:Cell_signaling, могут распространиться через клеточную мембрану и в цитоплазму, где они связывают ядерные en:Nuclear_receptor рецепторные белки. Там они служат факторами транскрипции en:Transcription_factor когда связано к их лиганде en:Ligand_(biochemistry); в отсутствии лиганда, много таких рецепторов функционируют как гистон deacetylases en:Histone_deacetylase, которые подавляют генное выражение.[19]
Ядерная тонкая пластинка[править | править код]
В ячейках животных, две сети промежуточных нитей en:Intermediate_filaments предоставляют ядру механическую поддержку: ядерная тонкая пластинка en:Nuclear_lamina формирует организованный meshwork на внутреннем лице конверта, в то время как менее организованная поддержка обеспечивается на цитозольном лице конверта. Обе системы обеспечивают структурную поддержку ядерному конверту и бросающим якорь участкам для хромосом и ядерных пор.[20]
Ядерная тонкая пластинка составлена главным образом lamin белков. Как все белки, lamins синтезируются в цитоплазме и позже транспортируются в интерьер ядра, где они собраны прежде, чем быть включенным в существующую сеть ядерной тонкой пластинки.[21][22] Lamins также найдены в nucleoplasm, где они формируют другую регулярную структуру, известную как завеса nucleoplasmic,[23] это - видимая микроскопия флюоресценции ! en:Fluorescence_microscopy использования. Фактическая функция завесы не ясна, хотя это исключено из nucleolus и присутствуетв течение межфазы en:Interphase.[24] lamin структуры, которые составляют завесу, связывают хроматин en:Chromatin, и разрушение их структуры запрещает транскрипцию кодирующих белок генов.[25]
Как компоненты других промежуточных нитей en:Intermediate_filament, lamin мономер en:Monomer содержит альфа-спиральную en:Alpha-helix область, используемую двумя мономерами, для намотки друг вокруг друга, формируя dimer структуру, названную намотанной катушкой en:Coiled_coil. Две из этих dimer структур соединяются рядом, в виде антипараллельного en:Antiparallel_(biochemistry) расположения, когда необходимо сформировать tetramer, названный protofilament. Восемь из этих protofilaments формируют боковое расположение, которое искривлено, чтобы сформировать нить, подобную верёвке. Эти нити могут быть собраны или демонтированы в манере динамики (движения), означая, что изменения в длине нити зависят от конкурирующих норм дополнения нити или удаления.[26]
Мутации в lamin генах, приводящих к дефектам на собрании нити, известны как laminopathies. Самый распространённый laminopathy — семья болезней, известных как progeria, вызывающая появление преждевременного старения en:Aging его страдальцев. Точный механизм, с которым связанны биохимические изменения, обусловленные возрастным началом фенотипа en:Phenotype, не достаточно понят.[27]
Хромосомы[править | править код]

Ядро клетки содержит большинство генетического материала клетки в форме многократных линейных молекул ДНК, организованных в структуры, названные хромосомами en:Chromosome. Каждая человеческая ячейка содержит 2m ДНК. В течение большинства циклов ячейки en:Cell_cycle они организованы в комплексе белка ДНК, известном как хроматин, и в течение деления клетки хроматин может быть замечен, чтобы сформировать четкие хромосомы en:Chromosome, знакомые из кариотипа en:Chromosome. Маленькая фракция генов клетки расположена в mitochondria en:Mitochondria.
Есть два типа хроматина. Euchromatin en:Euchromatin — менее компактная форма ДНК, и содержит гены, которые часто выражаются клеткой.[29] Другой тип, heterochromatin en:Heterochromatin, является более компактной формой, и содержит ДНК, которые не часто расшифровываются. Эта структура далее категоризирована в факультативный heterochromatin, состоя из генов, которые организованы как heterochromatin только в определенных типах клеток или в определенных стадиях развития, и учредительного heterochromatin, который состоит из структурных компонентов хромосомы, типа теломера en:Telomere и центромера. en:Centromere[30] В течение периода межфазового перехожа структуры хроматин организуется в дискретные индивидуальные участки,[31]названные территориями хромосомы.[32]Активные гены, которые, вообще, находятся в euchromatic области хромосомы, имеют тенденцию располагаться на границе территории хромосомы.[33]
Антитела определенных типов организации хроматина, в частности нуклеоса en:Nucleosome, были связаны с множеством аутоиммунных болезней en:Autoimmune_disease, типа системного lupus erythematosus en:Systemic_lupus_erythematosus.[34] Они известны как антиядерные антитела (СБОРНИК ИЗРЕЧЕНИЙ) и были также проявлены совместно с рассеянным склерозом en:Multiple_sclerosis как часть общей дисфункции иммунной системы.[35] Как в случае progeria, роль, влияния антител в стимулировании признаков аутоиммунных болезней не проявлена.
Nucleolus[править | править код]
Nucleolus en:Nucleolus — дискретная плотно упакованная структура, найденная в ядре. Она не окружена мембраной, и иногда называется подорганоидом. Это формируется вокруг тандемных (двойных) en:Tandem повторений rDNA, кодирования ДНК для рибосомной РНК (rRNA) en:Ribosomal_RNA. Эти области называют nucleolar областями организатора (НИ) en:Nucleolar_organizer_regions. Главные роли nucleolus должны синтезировать rRNA и собрать рибосомы. Структурное единство nucleolus зависит от его деятельности, поскольку рибосомное собрание в nucleolus приводит к переходной структуре nucleolar компонентов, облегчая далее созданию рибосомной структуры, и следовательно дальнейшей ассоциации. Эта модель подтвекрждается наблюдениями, которые показывают, что инактивация rDNA приводит к смешиванию nucleolar структур.[37]
Первый шаг на рибосомном уровне — транскрипция rDNA, на основе белка, названным как полимеризация РНК en:RNA_polymerase_I, формирующего больше pre-rRNA предшественника. Это расщеплено на подединицы 5.8S, 18, и 28 rRNA.[38] Транскрипция, посттранскрипционная обработка, и собрание rRNA происходят в nucleolus, которому помогает маленькая nucleolar РНК en:Small_nucleolar_RNA (snoRNA) молекулы, некоторые из которых получены из соединенных интронов en:Intron от РНК посыльного en:Messenger_RNA, кодирующих гены, связанные с рибосомной функцией. Собранные рибосомные подединицы - наибольшие структуры, проходил через ядерные поры.[39]
Когда всё соблюдено при электронной микроскопии en:Electron_microscope, nucleolus может быть замечен в виде трех различимых областей:
- самые внутренние волокнистые центры (FCs),
- FCs, окруженные плотным волокнистым компонентом (крест "За летные боевые заслуги"),
- в свою очередь (крест "За летные боевые заслуги") ограничен гранулированным компонентом (СБОРЩИК МУСОРА).
Транскрипция rDNA происходит или в FC или в границе FC-креста -"За-летные-боевые-заслуги", и, поэтому, когда образование rDNA в ячейке увеличено, то FCs обнаруживается больше. Большая часть распада и модификация rRNAs происходит в кресте "За летные боевые заслуги", в то время как последние шаги, вовлекающие сбор белка на уровне рибосомных подъединиц происходят в «СБОРЩИКЕ МУСОРА».[40]
Другие подядерные тела[править | править код]
| Название структуры | Диаметр структуры | |
|---|---|---|
| Cajal тела | 0.2–2.0 мкм | [41] |
| PIKA | 5 мкм | [42] |
| PML тела | 0.2–1.0 мкм | [43] |
| Паравеснушки | 0.2–1.0 мкм | [44] |
| Веснушки | 20–25 нм | [42] |
Помимо nucleolus, ядро содержит множество других, не подчёркнутых тел мембраны. Они включают: тела Cajal, Близнецов намотанных тел, полиморфную межфазу karyosomal ассоциации (PIKA), promyelocytic лейкемию (PML) тел, паравеснушек en:Paraspeckle и веснушек соединения. Хотя немного известно о приблизительном множестве этих областей, они существенно важны здесь, они показывают, что nucleoplasm не однородная смесь, а скорее всего содержит организованные функциональные подобласти.[45]
Другие подядерные структуры появляются как часть неверных процессов болезни. Например, о присутствии маленьких внутриядерных палочек было сообщение в некоторых случаях nemaline миопатии en:Nemaline_myopathy. Это условие типично следует из мутаций в actin, и сами палочки состоят из мутанта actin en:Actin так же как других cytoskeletal белков.[46]
Тела Cajal и драгоценные камни[править | править код]
Ядро типично содержит около от 1 до 10 компактных структур по имени тел Cajal или намотанные тела en:Cajal_body(ЦЕНТИБАР), диаметр которого имеет размеры между 0.2 мкм и 2.0 мкм в зависимости от типа ячейки и их разновидностей.[27] В электронном микроскопе замечено, что они напоминают шары запутанной нити[28] и - плотные очаги распределения для белка coilin.en:Coilin[32] CBs выполняют множество различных ролей, касающихся обработки РНК, определенно в роли маленькой nucleolar РНК (snoRNA) en:SnoRNA и созревания маленькой ядерной РНК (snRNA) en:Small_nuclear_RNA , и гистона mRNA модификации.[47]
Подобный телам Cajal — Близнец намотанных тел, или драгоценных камней, название которых получено из созвездия Близнеца в ссылке на их близкие отношения "близнеца" с CBs. Драгоценные камни подобны по размерам и форме с CBs, и фактически неразличимы под микроскопом.[48] В отличие от CBs, драгоценные камни не содержат маленький ядерный ribonucleoproteins (snRNPs), но действительно содержат белок, названный оставшимся в живых моторных нейронах (SMN) en:Neurons, функция которого имеет отношение к snRNP биогенетикой. Драгоценные камни, как полагают, помогают CBs в snRNP биогенетике,[49] хотя это также предложено на базе свидетельства микроскопии, и что CBs и драгоценные камни — различные проявления той же самой структуры.[50]
RAFA и области PTF[править | править код]
Области RAFA, или полиморфная межфаза karyosomal ассоциации, были сначала описаны в исследованиях микроскопии в 1991. Их функция была и остается неясной, хотя они, как думали, были не связаны с активным ответом ДНК, транскрипцией, или обработкой РНК.[51] Они, как находили, часто связывали с дискретными областями, определенными плотной локализацией фактора транскрипции PTF en:Transcription_factor, который продвигает транскрипцию snRNA en:SnRNA.[52]
Тела PML[править | править код]
Тела лейкемии Promyelocytic (тела PML) - сферические тела, найденные рассеянными всюду по nucleoplasm, измеряя приблизительно 0.2-1.0 µm. Они известны множеством других названий, включая ядерную область 10 (ND10), тела Kremer, и опухолеродные области PML. Они часто видятся в ядре в сотрудничестве с телами Cajal и телами раскола. Предложено, что они играют роль в регулировании транскрипции.[53]
Паравеснушки[править | править код]
Паравеснушки в анатомии сформированы нерегулярно как подклеточные купе, приблизительно с размерами 0.2-1 мкм, {клеточный} [54], найденные в ядре в месте межхроматина [55]. Сначала зарегистрированные как ячейки HeLa, где насчитывается вообще 10-30 в ядре[56], паравеснушки, как теперь известно, также существуют во всех человеческих первичных клетках, преобразованных линиях клетки и секциях ткани[57]. Их название получено из их распределения в ядре; "параграф" короток для сравнения, и от "веснушки" он обращается к веснушкам соединения, в которых они находятся всегда в непосредственной близости[58][3].[59]
Обнаруженный Лисой и др. в 2002, паравеснушки en:Paraspeckle — нерегулярно сформированные купе в месте межхроматина ядра.[60]
Паравеснушки - динамические структуры, которые изменены в ответ на изменения в клеточной метаболической деятельности. Они - иждивенец транскрипции[61] и в отсутствии Политика РНК II транскрипции, паравеснушка исчезает и все ее связанные компоненты белка (PSP1, p54nrb, PSP2, стоимость, фрахт и страхование (m) 68, и PSF) формируется, полумесяц сформировал кепку perinucleolar в nucleolus en:Nucleolus. Это явление демонстрируется в течение цикла клетки en:Cell_cycle. В цикле клетки, паравеснушки присутствуют в течение межфазы en:Interphase и в течение всех mitosis en:Mitosis за исключением telophase. В течение telophase en:Telophase, когда два ядра дочери сформированы, нет никакого Политика РНК en:RNA II транскрипции en:Transcription_(genetics), таким образом компоненты белка вместо этого формируют кепку perinucleolar.[62]
Соединение веснушек[править | править код]
Веснушки - подядерные структуры, которые обогащены в РНК предпосыльного, соединяющей факторы и расположены в областях межхроматина nucleoplasm относящихся к млекопитающим ячеек. На уровне микроскопа флюоресценции они появляются как нерегулярный, punctate структуры, которые изменяются по размеру и форме, и когда исследовано электронной микроскопией они замечены как группы гранул межхроматина. Веснушки - динамические структуры, и и их белок и компоненты белка РНК могут ездить на велосипеде непрерывно между веснушками и другими ядерными местоположениями, включая активные участки транскрипции. Исследования состава, структуры и поведения веснушек обеспечили модель чтобы понять функциональное разделение ядра и организации машин выражения гена.[63]
Иногда называемый группы гранулы межхроматина или как купе фактора соединения, веснушки богаты соединением snRNPs[64][65] и другие белки соединения, необходимые для обработки pre-mRNA.[66] Из-за требований изменения ячейки, состава и местоположения этих тел изменяется согласно mRNA транскрипции и регулированию через фосфорилирование en:Phosphorylation определенных белков.[67]
Функция[править | править код]
Главная функция ядра ячейки должна управлять генным выражением и добиваться ответа ДНК в течение цикла ячейки. Ядро обеспечивает участок для генетической транскрипции, которая является отдельной от местоположения перевода в цитоплазме, позволяя уровни генного регулирования, которые не доступны для prokaryotes.
Разделение ячейки[править | править код]
Ядерный конверт позволяет ядру управлять его содержанием и отделять их от остальной части цитоплазмы там, где необходимо. Это важно для того, чтобы управлять процессами с обеих сторон ядерной мембраны. В некоторых случаях, где цитоплазматический процесс должен быть ограничен, ключевой участник удаляетя к ядру, где взаимодействует с факторами транскрипции к downregulate производства определенных ферментов в тропе. Этот регулирующий механизм происходит в случае glycolysis en:Glycolysis, когда клеточная тропа нужна для того, чтобы ломать глюкозу, чтобы произвести энергию. Hexokinase en:Hexokinase - фермент, ответственный за первый шаг glycolysis, формирующий glucose-6-phosphate en:Glucose-6-phosphate от глюкозы. При высоких концентрациях fructose-6-phosphate, молекула создаётся позже из glucose-6-phosphate, и белок регулятора удаляет hexokinase к ядру,[68] где он формирует транскрипционный комплекс гена — репрессора с ядерными белками, чтобы уменьшить выражение генов, вовлеченных в glycolysis.[69]
Чтобы управлять, определить какие гены расшифровываются, ячейка отделяет некоторые белки фактора транскрипции en:Transcription_factor, ответственные за то, чтобы регулировать генное выражение от физического доступа к ДНК, пока они не активизированы другими тропами передачи сигналов. Это предотвращает даже низкие уровни несоответствующего генного выражения. Например, в случае Ньюфаундленда - NF-ОєB-controlled en:NF-κB, гены, вовлеченные в большинство неадэкватных ответов en:Inflammation, транскрипция вызывается к ответу на тропу сигнала en:Cell_signaling, типа начатого сигнализирующей молекулой TNF-О±, en:TNF-α связывает с рецептором мембраны клетки, приводя к вербовке сигнальных белков, и в конечном счете активизирует фактор транскрипции Ньюфаундленд-ОєB. Ядерный сигнал локализации en:Nuclear_localisation_signal на Ньюфаундленда-ОєB белок позволяет этому транспортироваться через ядерную пору и в ядро, где это стимулирует транскрипцию целевых генов.[70]
Разделение позволяет ячейке предотвращать перевод несоединенных mRNA.[71] Eukaryotic mRNA содержит интроны en:Introns, которые должны быть удалены прежде, чем быть переведенным, чтобы произвести функциональные белки. Соединение сделано в ядре прежде, чем к mRNA можно получить доступ рибосомами для перевода. Без ядра, рибосомы перевели бы недавно расшифрованный (необработанный) mRNA, приводя misformed и атрофированные белки.
Генное выражение[править | править код]

Генное выражение сначала вовлекает «транскрипцию» en:Transcription_(genetics), в которой ДНК используется как шаблон, чтобы произвести РНК. В случае генов, кодирующих белки, та РНК, произведенная от этого процесса - РНК посыльного en:Messenger_RNA (mRNA), который тогда должен быть переведен en:Translation_(genetics) рибосомами en:Ribosomes, чтобы сформировать белок. Поскольку рибосомы расположены вне ядра, востребованные mRNA экспортируются.[73]
Так как ядро - участок транскрипции, то это также содержит разнообразие белков, которые или непосредственно добиваются транскрипции или вовлечены в регулирование процесса. Эти белки включают helicases en:Helicase, которые раскручивают двойное-переплетение молекулы ДНК, чтобы облегчить доступ к этим полимеразам РНК en:RNA_polymerase, которые синтезируют растущую молекулу РНК, topoisomerases, которые изменяют количество супернамотки в ДНК, помогая этому процессу проветрить и раскручивать, так же, как большому разнообразию факторов транскрипции en:Transcription_factor, которые регулируют выражение.[74]
Обработка pre-mRNA[править | править код]
Недавно синтезируемые mRNA молекулы известны как первичные расшифровки стенограммы en:Primary_transcript или как pre-mRNA. Они должны быть подвергнуты посттранскрипционной модификации[ [:en:Post-transcriptional_modification]] в ядре прежде, чем быть экспортируемыми в цитоплазму; mRNA, появляющийся в цитоплазме без этих модификаций скорее ухудшен, вместо использования для перевода en:Translation_(genetics) белка.
Существуют три главных модификации:
В то время как в ядре, pre-mRNA связан с разнообразием белков в комплексах известны как гетерогенные ribonucleoprotein частицы en:Heterogeneous_ribonucleoprotein_particle(hnRNPs). Дополнение 5' кепок происходит cо-transcriptionally и - первый шаг в посттранскрипционной модификации. 3' хвоста многоаденина только добавлены после того, как транскрипция полна. (аденин en:Adenine)
Соединение РНК, выполненное комплексом, названный spliceosome en:Spliceosome, является процессом, который у интронов en:Introns, или в областях ДНК, где не кодируется белок, и после удаления их из pre-mRNA, то у остающихся связанных экзонов они преобразовывают единственную непрерывную молекулу. Этот процесс обычно происходит после 5' покровов и 3' polyadenylation, но может начаться прежде, чем синтез наполнится расшифровками стенограммы многих экзонов en:Exon.[75] Много pre-mRNAs, включая те, которые кодируют антитела en:Antibody, могут быть соединены многократными способами производства различных зрелых mRNAs, которые кодируют различные последовательности белка en:Primary_structure#Primary_Structure. Этот процесс известен как альтернативное соединение en:Alternative_splicing, и позволяет производить большее разнообразие белков от ограниченного количества ДНК.
Динамика и регулирование[править | править код]
Ядерный транспорт[править | править код]
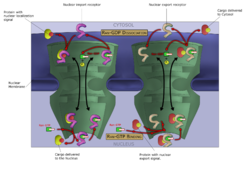
Макромолекулы, типа РНК и белков, активно транспортируются поперек (нормально параллельным перегородкам) ядерной мембраны в процессе, названном Управлением-GTP ядерным транспортным циклом. Входом и выходом больших молекул от ядра сильно управляют ядерные комплексы пор. Хотя маленькие молекулы могут войти в ядро без регулирования,[77] макромолекулы, типа РНК и белков требуют, чтобы ассоциация karyopherins en:Karyopherin, названная importins en:Importin, вошла в ядро и exportins en:Exportin, чтобы выйти. «Грузовые» белки, которые должны быть перемещены от цитоплазмы до ядра, содержат короткие последовательности аминокислот, известные как ядерные сигналы локализации en:Nuclear_localization_signal, которые связаны importins, в то время как транспортируемые от ядра до цитоплазмы, они несут ядерные экспортные сигналы en:Nuclear_localization_signal, связанные с экспортом (exportins).
Способность «importins» и «exportins», чтобы транспортировать их груз, регулируется GTPases en:GTPase, ферментами, которые гидролизируют en:Hydrolyze молекулу guanosine трифосфат en:Guanosine_triphosphate, чтобы выпустить энергию. Ключевой GTPase в ядерном транспорте «Бежал» en:Ran_(biology), который может связать или GTP или валовой внутренний продукт (guanosine diphosphate) в зависимости от того, расположено ли это в ядре или цитоплазме. Принимая во внимание, что «importins» зависят от RanGTP, чтобы отделить его от груза, а «exportins» требуют от RanGTP, чтобы связать его с грузом .[78]
Ядерный импорт зависит от «importins» в закрепление его груза в цитоплазме и переносе этого через ядерную пору в ядро. В ядре, действия RanGTP, чтобы отделить груз от «importin», позволяя «importin» выходить из ядра и многократно использоваться. Ядерный экспорт подобен, поскольку «exportin» связывает груз в ядре в процессе, облегченном RanGTP, с выходами через ядерную пору, и отделяется от ее груза в цитоплазме.
Специализированные экспортные белки существуют для перемещения зрелого mRNA и tRNA к цитоплазме после того, как посттранскрипционная модификация полна. Этот механизм проверки качества важен из-за центральной роли этих молекул в переводе белка; неправильное выражение белка из-за неполного вырезания экзонов или неправильного объединения аминокислот могло иметь отрицательные последствия для клетки; таким образом, не полностью измененная РНК, которая достигает цитоплазмы, ухудшена, вместо того, чтобы использоваться в переводе.[79]
Собрание и разборка[править | править код]
В течение целой жизни ядра, оно может быть сломано, или в процессе разделения ячейки en:Cell_division или как следствие apoptosis en:Apoptosis — регулируемая форма смерти клетки. В течение этих событий, систематически ухудшаются структурные компоненты ядра — конверта и тонкой пластинки.
В течение цикла клетки en:Cell_cycle клетка делится, чтобы сформировать две клетки. Для этого процесса, чтобы стать возможным, каждая из новых клеток дочери должна иметь полный набор генов, иметь процесс, требующий ответа хромосом так же как сегрегации отдельных наборов. Это происходит копируемыми хромосомами, сестёр chromatids en:Sister_chromatid, которые имеют свойства микроканальцев en:Microtubule, которые в свою очередь присоединены к различным центросомам en:Centrosome. Сестру chromatids en:Sister_chromatid можно в этом случае тянуть, чтобы отделить местоположения в клетке. Во многих клетках, центросома en:Centrosome расположена в цитоплазме, вне ядра; микроканальцы были бы неспособными иметь свойства chromatids в присутствии ядерного конверта.[81] Поэтому ранние стадии в цикле клетки, начинающемся в профазе en:Prophase и до состояния прометафазы en:Prometaphase приблизительно того состояния, когда ядерная мембрана демонтируется.[82] Аналогично, в течение того же самого периода, ядерная тонкая пластинка также демонтируется процессом, который регулирует фосфорилирование lamins.[83] К концу цикла клетки, ядерная мембрана преобразуется, и в течение того же самого времени, ядерная тонкая пластинка повторно становится собранной в dephosphorylating lamins.[84]
Однако, в dinoflagellates en:Dinoflagellates, ядерный конверт остается неповрежденным. Центросомы остаются расположенными в цитоплазме, микроканальцы только приходили в соприкосновение с хромосомами, центральные измерительные параметры (centromeric) их областей находятся в ядерном конверте (так называемое закрыло mitosis с extranuclear шпинделем). Во многих других protists (например, ciliates en:Ciliate, sporozoans en:Apicomplexa) и грибов, центросомы являются внутриядерными, и их ядерный конверт также не делает disassemle в течение разделения ячейки.
«Apoptosis» en:Apoptosis — процесс, которым управляют, в котором структурные компоненты клетки разрушены, приводя к смерти клетки. Изменения, связанные «Apoptosis» непосредственно затрагивают ядро и его содержание, например, в уплотнении хроматина и распада ядерного конверта и тонкой пластинки. Разрушением lamin сетей управляют специализированные apoptotic протеазы en:Protease, названные caspases [:en:Caspase]], которые раскалывают lamin белки и, таким образом, ухудшают структурную целостность ядра. Раскол Lamin иногда используется как лабораторный индикатор caspase деятельности в испытании en:Assay для ранней apoptotic деятельности.[85] Клетки, которые выражают мутант caspase-стойкий lamins, являются несовершенными в ядерных изменениях, связанных с apoptosis, предлагая, что lamins играют роль во введении событий, которые приводят к apoptotic деградации ядра.[86] Запрещение самого lamin собрания — индуктор apoptosis.[87]
Ядерный конверт действует как барьер, который препятствует и ДНК и вирусам РНК входить в ядро. Требуется немного вирусов для доступа к белкам в ядре, чтобы самим копироваться и/или собраться. Вирусы ДНК, типа herpesvirus en:Herpesvirus копируют его и собираются в ядре ячейки, и выходе, расцветая через внутреннюю ядерную мембрану. Этот процесс сопровождается разборкой тонкой пластинки на ядерном лице внутренней мембраны.[88]
Безъядерные и многоядерные клетки[править | править код]

Хотя большинство клеток имеет единственное ядро, некоторые eukaryotic типов клетки не имеют никакого ядра, а другие имеют много ядер. Это может быть нормальным процессом, как в созревании у млекопитающих красных кровяных клеток en:Red_blood_cell, или как результат дефектного разделения клетки.
Клетки Anucleated не содержат никакого ядра и, поэтому, неспособны к делению, чтобы произвести клетки «дочери». Самая известная anucleated ячейка,относящаяся к млекопитающим — красная кровяная клетка, или эритоцит, который также испытывает недостаток в других органоидах, типа mitochondria en:Mitochondria, и служит прежде всего как транспортное судно кислородного парома от лёгких к тканям тела. Эритоциты созревают посредсвом в костном мозгу en:Bone_marrow, где они теряют свои ядра, органоиды, и рибосомы. Ядро удаляется в течение процесса дифференцирования от erythroblast до reticulocyte, который является непосредственным предшественником зрелого эритоцита.[90] Присутствие мутагенов может вызвать выпуск некоторых незрелых "micronucleated" эритоцитов в кровоток.[91][92]Ячейки Anucleated могут также явиться результатом некорректного разделения ячейки, в котором одна дочь испытывает недостатокв ядре, и другой имеет два ядра.
Ячейки Polynucleated содержат многократные ядра. Большинство разновидностей Acantharean en:Acantharea protozoa]] en:Protozoa[93] и некоторые грибы в mycorrhizae en:Mycorrhizae[94] имеют естественно polynucleated клетки. Другие примеры включают кишечных паразитов en:Intestinal_parasite в род Giardia en:Giardia, которые имеют два ядра в клетке.[95] У людей, в скелетных en:Skeletal_muscle клетках мускула, названных myocytes en:Myocyte, становятся polynucleated в течение развития; получающаяся договоренность ядер около периферии ячеек позволяет иметь максимальное внутриклеточное место для myofibrils en:Myofibrils.[96] Клетки Multinucleated могут также быть неправильными у людей; например, клетки в результатате сплава моноцитов en:Monocyteи макрофагов en:Macrophage, известные как гигантские multinucleated клетки en:Giant_multinucleated_cell, иногда вызывают воспаление[97] и также вовлечены в формировании опухолей.[98]
Развитие[править | править код]
Как главная особенность определения «eukaryotic» клетки, эволюционное происхождение ядра было предметом больших гипотез. Четыре главных теорий были предложены, чтобы объяснить существование ядра, хотя ни одна все же не заработала и не получила широкой распространённой поддержки.[99]
Теория, известная как "syntrophic модель" предлагает, чтобы символические en:Symbiosis отношения между archaea en:Archaea и бактериями en:Bacteria создали содержание ядра как eukaryotic клетки. (Организмы области Archaea — безядерные клетки.[100]) Это вероятно симбиоз, порожденный в древние времена archaea, подобный современному methanogenic en:Methanogenesis archaea, который вторгся и жил в пределах бактерий, подобных современному myxobacteria en:Myxobacteria, и в конечном счете формирует раннее ядро. Эта теория походит на принятую теорию для происхождения eukaryotic mitochondria en:Mitochondria и хлоропластов en:Chloroplast, которые, как думают, развились от подобных endosymbiotic отношений между прото--eukaryotes и аэробными бактериями.[101] Аrchaeal происхождение ядра поддержано наблюдениями, показывающие, что archaea и eukarya имеют подобные гены для определенных белков, включая гистоны en:Histone. Наблюдения, что myxobacteria являются motile, могут сформировать многоклеточные комплексы, и обладать киназами en:Kinase и белками Г en:G_protein, подобными eukarya, поддерживать бактериальное происхождение для eukaryotic клетки.[102]
Вторая модель предлагает, чтобы прото--eukaryotic ячейки развились от бактерий без endosymbiotic стадии. Эта модель основана на существовании современных planctomycetes бактерий, которые обладают ядерной структурой с примитивными порами и другими разделенными мембранными структурами.[103] Подобное предложение заявляет, что eukaryote-подобная ячейка, chronocyte en:Chronocyte, развилась сначала как и phagocytosed en:Phagocytosed archaea и бактерии, чтобы произвести ядро и eukaryotic ячейку.[104]
Самая спорная модель, известная как вирусный eukaryogenesis en:Viral_eukaryogenesis, который устанавливает, это направляющееся к мембране ядро, которое наряду с другими особенностями eukaryotic, являются порожденными из инфекции prokaryote вирусом. Предложение основано на подобиях между eukaryotes и вирусами, типа линейных берегов ДНК, mRNA покров, и напряженное закрепление с белками (изображающий гистоны en:Histone по аналогии к вирусным конвертам en:Viral_envelope). Одна версия предложения предлагает, что ядро развилось совместно с phagocytosis en:Phagocytosis, чтобы сформировать раннего клеточного "хищника" en:Predator.[105] Другой вариант предлагает, чтобы eukaryotes произошел из раннего archaea en:Archaea, зараженного poxviruses en:Poxvirus, на основе наблюдаемого подобия между полимеразами ДНК en:DNA_polymerase в современном poxviruses и eukaryotes.[106][107]Предложено, что нерешенный вопрос развития секса en:Evolution_of_sex мог быть связан с вирусной eukaryogenesis гипотезой.[108]
Очень недавнее предложение предлагает, что традиционные варианты endosymbiont теории недостаточно мощны, чтобы объяснить происхождение eukaryotic ядра. Эта модель, которую называют exomembrane гипотезой, предлагает, что ядро вместо этого произошло из единственной наследственной ячейки, которая развила вторую внешнюю мембрану ячейки; внутренняя мембрана, прилагающая оригинальную ячейку, тогда стала ядерной мембраной и развила все более и более сложные структуры поры для прохода внутренне синтезируемых клеточных компонентов, типа рибосомных en:Ribosome подединиц.[109]
Галерея изображений ядра[править | править код]
Сравнение хромосом человека и хромосом шимпанзе.
Далее чтение[править | править код]
Внешние связи[править | править код]
См. также[править | править код]
Примечания[править | править код]
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Leeuwenhoek, A. van: Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719–1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. Verlag Harry Deutsch, Frankfurt am Main, Germany, 2009. ISBN 978-3-8171-1781-9.
- ↑ Harris, H (1999). The Birth of the Cell. New Haven: Yale University Press. ISBN 0-300-07384-4.
- ↑ Brown, Robert (1866). "On the Organs and Mode of Fecundation of Orchidex and Asclepiadea". Miscellaneous Botanical Works I: 511–514.
- ↑ Cremer, Thomas (1985). Von der Zellenlehre zur Chromosomentheorie. Berlin, Heidelberg, New York, Tokyo: Springer Verlag. ISBN 3-540-13987-7. Online Version here
- ↑ Cremer, Thomas (1985). Von der Zellenlehre zur Chromosomentheorie. Berlin, Heidelberg, New York, Tokyo: Springer Verlag. ISBN 3-540-13987-7. Online Version here
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, ed (2002). Molecular Biology of the Cell, Chapter 4, pages 191-234 (4th ed.). Garland Science.
- ↑ http://dic.academic.ru/dic.nsf/eng_rus/182962/%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D0%BF%D0%BB%D0%B0%D0%B7%D0%BC%D0%B0
- ↑ Clegg JS (February 1984). "Properties and metabolism of the aqueous cytoplasm and its boundaries". Am. J. Physiol. 246 (2 Pt 2): R133–51. PMID 6364846. http://ajpregu.physiology.org/cgi/pmidlookup?view=reprint&pmid=6364846.
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Paine P, Moore L, Horowitz S (1975). "Nuclear envelope permeability". Nature 254 (5496): 109–114. doi:10.1038/254109a0. PMID 1117994.
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ Rodney Rhoades, Richard Pflanzer, ed (1996). "Ch3". Human Physiology (3rd ed.). Saunders College Publishing.
- ↑ Shulga N, Mosammaparast N, Wozniak R, Goldfarb D (2000). "Yeast nucleoporins involved in passive nuclear envelope permeability". J Cell Biol 149 (5): 1027–1038. doi:10.1083/jcb.149.5.1027. PMID 10831607.
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ Pemberton L, Paschal B (2005). "Mechanisms of receptor-mediated nuclear import and nuclear export". Traffic 6 (3): 187–198. doi:10.1111/j.1600-0854.2005.00270.x. PMID 15702987.
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, ed (2002). Molecular Biology of the Cell, Chapter 4, pages 191–234 (4th ed.). Garland Science.
- ↑ Stuurman N, Heins S, Aebi U (1998). "Nuclear lamins: their structure, assembly, and interactions". J Struct Biol 122 (1–2): 42–66. doi:10.1006/jsbi.1998.3987. PMID 9724605.
- ↑ Goldman A, Moir R, Montag-Lowy M, Stewart M, Goldman R (1992). "Pathway of incorporation of microinjected lamin A into the nuclear envelope". J Cell Biol 119 (4): 725–735. doi:10.1083/jcb.119.4.725. PMID 1429833.
- ↑ Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T (2002). "Nuclear lamins: building blocks of nuclear architecture". Genes Dev 16 (5): 533–547. doi:10.1101/gad.960502. PMID 11877373. http://www.genesdev.org/cgi/content/full/16/5/533.
- ↑ Moir RD, Yoona M, Khuona S, Goldman RD. (2000). "Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells". Journal of Cell Biology 151 (6): 1155–1168. doi:10.1083/jcb.151.6.1155. PMID 11121432.
- ↑ Spann TP, Goldman AE, Wang C, Huang S, Goldman RD. (2002). "Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription". Journal of Cell Biology 156 (4): 603–608. doi:10.1083/jcb.200112047. PMID 11854306.
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, ed (2002). Molecular Biology of the Cell, Chapter 4, pages 191–234 (4th ed.). Garland Science.
- ↑ Mounkes LC, Stewart CL (2004). "Aging and nuclear organization: lamins and progeria". Current Opinion in Cell Biology 16: 322–327. doi:10.1016/j.ceb.2004.03.009. PMID 15145358.
- ↑ http://en.wikipedia.org/wiki/Fluorescent_in_situ_hybridization
- ↑ Ehrenhofer-Murray A (2004). "Chromatin dynamics at DNA replication, transcription and repair". Eur J Biochem 271 (12): 2335–2349. doi:10.1111/j.1432-1033.2004.04162.x. PMID 15182349.
- ↑ Grigoryev S, Bulynko Y, Popova E (2006). "The end adjusts the means: heterochromatin remodelling during terminal cell differentiation". Chromosome Res 14 (1): 53–69. doi:10.1007/s10577-005-1021-6. PMID 16506096
- ↑ Schardin, Margit; Cremer, T; Hager, HD; Lang, M (December 1985). "Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories". Human Genetics (Springer Berlin / Heidelberg) 71 (4): 281–287. doi:10.1007/BF00388452. PMID 2416668. http://www.springerlink.com/content/lv101t8w17306071/.
- ↑ Lamond, Angus I.; William C. Earnshaw (1998-04-24). "Structure and Function in the Nucleus". Science 280 (5363): 547–553. doi:10.1126/science.280.5363.547. PMID 9554838.
- ↑ Kurz, A; Lampel, S; Nickolenko, JE; Bradl, J; Benner, A; Zirbel, RM; Cremer, T; Lichter, P (1996). "Active and inactive genes localize preferentially in the periphery of chromosome territories". The Journal of Cell Biology (The Rockefeller University Press) 135 (5): 1195–1205. doi:10.1083/jcb.135.5.1195. PMC 2121085. PMID 8947544. http://intl.jcb.org/cgi/content/abstract/135/5/1195.
- ↑ NF Rothfield, BD Stollar (1967). "The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus". J Clin Invest 46 (11): 1785–1794. doi:10.1172/JCI105669. PMC 292929. PMID 4168731. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez artid=292929.
- ↑ S Barned, AD Goodman, DH Mattson (1995). "Frequency of anti-nuclear antibodies in multiple sclerosis". Neurology 45 (2): 384–385. PMID 7854544.
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Hernandez-Verdun, Daniele (2006). "Nucleolus: from structure to dynamics". Histochem. Cell. Biol 125 (1-2): 127–137. doi:10.1007/s00418-005-0046-4. PMID 16328431
- ↑ Lamond, Angus I.; Judith E. Sleeman. "Nuclear substructure and dynamics". Current Biology 13 (21): R825–828. doi:10.1016/j.cub.2003.10.012. PMID 14588256.
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ Lamond, Angus I.; Judith E. Sleeman. "Nuclear substructure and dynamics". Current Biology 13 (21): R825–828. doi:10.1016/j.cub.2003.10.012. PMID 14588256.
- ↑ Cioce M, Lamond A. "Тела Cajal : a long history of discovery". Annu Rev Cell Dev Biol 21: 105–131. DOI:10.1146/annurev.cellbio.20.010403.103738. PMID 16212489.
- ↑ а б Thomas D. Pollard Cell Biology. — Philadelphia: Saunders, 2004. — ISBN 0-7216-3360-9о книге
- ↑ Dundr, Miroslav; Tom Misteli (2001). "Functional architecture in the cell nucleus". Biochem. J. (356): 297–310. PMID 11368755.
- ↑ Шаблон:Cite interview
- ↑ Dundr, Miroslav; Tom Misteli (2001). "Functional architecture in the cell nucleus". Biochem. J. (356): 297–310. PMID 11368755.
- ↑ Goebel, H.H.; I Warlow (January 1997). "Nemaline myopathy with intranuclear rods—intranuclear rod myopathy". Neuromuscular Disorders 7 (1): 13–19. doi:10.1016/S0960-8966(96)00404-X. PMID 9132135.
- ↑ Cioce M, Lamond A (2005). "Cajal bodies: a long history of discovery". Annu Rev Cell Dev Biol 21: 105–131. doi:10.1146/annurev.cellbio.20.010403.103738. PMID 16212489.
- ↑ Matera AG, Frey MA. (1998). "Coiled Bodies and Gems: Janus or Gemini?". American Journal of Human Genetics 63 (2): 317–321. doi:10.1086/301992. PMID 9683623.
- ↑ Matera, A. Gregory (1998). "Of Coiled Bodies, Gems, and Salmon". Journal of Cellular Biochemistry (70): 181–192. PMID 9671224.
- ↑ Matera AG, Frey MA. (1998). "Coiled Bodies and Gems: Janus or Gemini?". American Journal of Human Genetics 63 (2): 317–321. doi:10.1086/301992. PMID 9683623.
- ↑ Saunders WS, Cooke CA, Earnshaw WC (1991). "Compartmentalization within the nucleus: discovery of a novel subnuclear region.". Journal of Cellular Biology 115 (4): 919–931. doi:10.1083/jcb.115.4.919. PMID 1955462
- ↑ Pombo A, Cuello P, Schul W, Yoon J, Roeder R, Cook P, Murphy S (1998). "Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle". EMBO J 17 (6): 1768–1778. doi:10.1093/emboj/17.6.1768. PMID 9501098.
- ↑ Dundr, Miroslav; Tom Misteli (2001). "Functional architecture in the cell nucleus". Biochem. J. (356): 297–310. PMID 11368755.
- ↑ Fox, Archa. Interview with R. Sundby. Paraspeckle Size. E-mail Correspondence. 2007-03-07
- ↑ Fox, A. et al. (2002). "Paraspeckles: A Novel Nuclear Domain". Current Biology 12 (1): 13–25. doi:10.1016/S0960-9822(01)00632-7. PMID 11790299
- ↑ Fox, Archa; Wendy Bickmore (2004). "Nuclear Compartments: Paraspeckles". doi:6 March 2007.. http://npd.hgu.mrc.ac.uk/compartments/paraspeckles.html.
- ↑ Fox, A. et al. (2005). "P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner". Molecular Biology of the Cell 16 (11): 5304–15. doi:10.1091/mbc.E05-06-0587. PMC 1266428. PMID 16148043. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1266428.
- ↑ Fox, Archa; Wendy Bickmore (2004). "Nuclear Compartments: Paraspeckles". doi:6 March 2007.. http://npd.hgu.mrc.ac.uk/compartments/paraspeckles.html.
- ↑ http://en.wikipedia.org/wiki/Paraspeckle
- ↑ Fox, Archa; Lam, YW; Leung, AK; Lyon, CE; Andersen, J; Mann, M; Lamond, AI (2002). "Paraspeckles:A Novel Nuclear Domain". Current Biology 12 (1): 13–25. doi:10.1016/S0960-9822(01)00632-7. PMID 11790299. http://www.current-biology.com/content/article/abstract?uid=PIIS0960982201006327.
- ↑ Fox, Archa; Lam, YW; Leung, AK; Lyon, CE; Andersen, J; Mann, M; Lamond, AI (2002). "Paraspeckles:A Novel Nuclear Domain". Current Biology 12 (1): 13–25. doi:10.1016/S0960-9822(01)00632-7. PMID 11790299. http://www.current-biology.com/content/article/abstract?uid=PIIS0960982201006327.
- ↑ Fox, A. et al. (2005). "P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner". Molecular Biology of the Cell 16 (11): 5304–5315. doi:10.1091/mbc.E05-06-0587. PMC 1266428. PMID 16148043. http://www.molbiolcell.org/cgi/reprint/16/11/5304.
- ↑ Lamond AI, Spector DL (August 2003). "Nuclear speckles: a model for nuclear organelles". Nat. Rev. Mol. Cell Biol. 4 (8): 605–12. doi:10.1038/nrm1172. PMID 12923522.
- ↑ Tripathi, K; Parnaik, VK (2008). "Differential dynamics of splicing factor SC35 during the cell cycle". Journal of biosciences 33 (3): 345–54. PMID 19005234. edit
- ↑ Tripathi, K; Parnaik, VK (2008). "Differential dynamics of splicing factor SC35 during the cell cycle". Journal of biosciences 33 (3): 345–54. PMID 19005234. edit
- ↑ Lamond AI, Spector DL (August 2003). "Nuclear speckles: a model for nuclear organelles". Nat. Rev. Mol. Cell Biol. 4 (8): 605–12. doi:10.1038/nrm1172. PMID 12923522.
- ↑ Handwerger, Korie E.; Joseph G. Gall (January 2006). "Subnuclear organelles: new insights into form and function". TRENDS in Cell Biology 16 (1): 19–26. doi:10.1016/j.tcb.2005.11.005. PMID 16325406.
- ↑ Lehninger, Albert L.; David L. Nelson, Michael M. Cox. (2000). Lehninger principles of biochemistry (3rd ed.). New York: Worth Publishers. ISBN 1-57259-931-6.
- ↑ Moreno F, Ahuatzi D, Riera A, Palomino CA, Herrero P. (2005). "Glucose sensing through the Hxk2-dependent signalling pathway.". Biochem Soc Trans 33 (1): 265–268. doi:10.1042/BST0330265. PMID 15667322. PMID 15667322
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, ed (2002). Molecular Biology of the Cell, Chapter 4, pages 191–234 (4th ed.). Garland Science.
- ↑ Görlich, Dirk; Ulrike Kutay (1999). "Transport between the cell nucleus and the cytoplasm". Ann. Rev. Cell Dev. Biol. 15 (1): 607–660. doi:10.1146/annurev.cellbio.15.1.607. PMID 10611974.
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Nierhaus, Knud H.; Daniel N. Wilson (2004). Protein Synthesis and Ribosome Structure: Translating the Genome. Wiley-VCH. ISBN 3-527-30638-2.
- ↑ Nicolini, Claudio A. (1997). Genome Structure and Function: From Chromosomes Characterization to Genes Technology. Springer. ISBN 0-7923-4565-7.
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, ed (2002). Molecular Biology of the Cell, Chapter 4, pages 191–234 (4th ed.). Garland Science.
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Watson, JD; Baker TA, Bell SP, Gann A, Levine M, Losick R. (2004). "Ch9–10". Molecular Biology of the Gene (5th ed.). Peason Benjamin Cummings; CSHL Press.. ISBN 0-8053-9603-9.
- ↑ Pemberton L, Paschal B (2005). "Mechanisms of receptor-mediated nuclear import and nuclear export". Traffic 6 (3): 187–198. doi:10.1111/j.1600-0854.2005.00270.x. PMID 15702987.
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Lippincott-Schwartz, Jennifer (2002-03-07). "Cell biology: Ripping up the nuclear envelope". Nature 416 (6876): 31–32. doi:10.1038/416031a. PMID 11882878.
- ↑ Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T (2002). "Nuclear lamins: building blocks of nuclear architecture". Genes Dev 16 (5): 533–547. doi:10.1101/gad.960502. PMID 11877373. http://www.genesdev.org/cgi/content/full/16/5/533.
- ↑ Boulikas T (1995). "Phosphorylation of transcription factors and control of the cell cycle". Crit Rev Eukaryot Gene Expr 5 (1): 1–77. PMID 7549180.
- ↑ Boulikas T (1995). "Phosphorylation of transcription factors and control of the cell cycle". Crit Rev Eukaryot Gene Expr 5 (1): 1–77. PMID 7549180.
- ↑ Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T (2002). "Nuclear lamins: building blocks of nuclear architecture". Genes Dev 16 (5): 533–547. doi:10.1101/gad.960502. PMID 11877373. http://www.genesdev.org/cgi/content/full/16/5/533.
- ↑ Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T (2002). "Nuclear lamins: building blocks of nuclear architecture". Genes Dev 16 (5): 533–547. doi:10.1101/gad.960502. PMID 11877373. http://www.genesdev.org/cgi/content/full/16/5/533.
- ↑ Steen R, Collas P (2001). "Mistargeting of B-type lamins at the end of mitosis: implications on cell survival and regulation of lamins A/C expression". J Cell Biol 153 (3): 621–626. doi:10.1083/jcb.153.3.621. PMID 11331311
- ↑ Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T (2002). "Nuclear lamins: building blocks of nuclear architecture". Genes Dev 16 (5): 533–547. doi:10.1101/gad.960502. PMID 11877373. http://www.genesdev.org/cgi/content/full/16/5/533.
- ↑ http://en.wikipedia.org/wiki/Cell_nucleus
- ↑ Skutelsky, E.; Danon D. (June 1970). "Comparative study of nuclear expulsion from the late erythroblast and cytokinesis". J Cell Biol (60(3)): 625–635. PMID 5422968.
- ↑ Torous, DK; Dertinger SD, Hall NE, Tometsko CR. (2000). "Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study". Mutat Res (465(1–2)): 91–99. PMID 10708974.
- ↑ Hutter, KJ; Stohr M. (1982). "Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry". Histochemistry 75 (3): 353–362. PMID 7141888.
- ↑ Zettler, LA; Sogin ML, Caron DA (1997). "Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria". Proc Natl Acad Sci USA 94 (21): 11411–11416. doi:10.1073/pnas.94.21.11411. PMC 23483. PMID 9326623. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=23483.
- ↑ Horton, TR (2006). "The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes". Mycologia 98 (2): 233–238. PMID 16894968.
- ↑ Adam RD (December 1991). "The biology of Giardia spp". Microbiol. Rev. 55 (4): 706–32. PMC 372844. PMID 1779932. http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=1779932.
- ↑ Lodish, H; Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6.
- ↑ McInnes, A; Rennick DM (1988). "Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells". J Exp Med (167): 598–611. PMID 3258008.
- ↑ Goldring, SR; Roelke MS, Petrison KK, Bhan AK (1987). "Human giant cell tumors of bone identification and characterization of cell types". J Clin Invest 79 (2): 483–491. PMID 3027126.
- ↑ Pennisi E. (2004). "Evolutionary biology. The birth of the nucleus". Science 305 (5685): 766–768. doi:10.1126/science.305.5685.766. PMID 15297641
- ↑ C.Michael Hogan. 2010. Archaea. eds. E.Monosson & C.Cleveland, Encyclopedia of Earth. National Council for Science and the Environment, Washington DC.
- ↑ Margulis, Lynn (1981). Symbiosis in Cell Evolution. San Francisco: W. H. Freeman and Company. pp. 206–227. ISBN 0-7167-1256-3.
- ↑ Lopez-Garcia P, Moreira D. (2006). "Selective forces for the origin of the eukaryotic nucleus". Bioessays 28 (5): 525–533. doi:10.1002/bies.20413. PMID 16615090.
- ↑ Fuerst JA. (2005). "Intracellular compartmentation in planctomycetes". Annu Rev Microbiol. 59: 299–328. doi:10.1146/annurev.micro.59.030804.121258. PMID 15910279.
- ↑ Hartman H, Fedorov A. (2002). "The origin of the eukaryotic cell: a genomic investigation". Proc Natl Acad Sci U S A. 99 (3): 1420–1425. doi:10.1073/pnas.032658599. PMC 122206. PMID 11805300. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=122206.
- ↑ Bell PJ (September 2001). "Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?". J. Mol. Evol. 53 (3): 251–6. doi:10.1007/s002390010215. PMID 11523012.
- ↑ Takemura M (2001). "Poxviruses and the origin of the eukaryotic nucleus". J Mol Evol 52 (5): 419–425. doi:10.1007/s002390010171. PMID 11443345.
- ↑ Villarreal L, DeFilippis V (2000). "A hypothesis for DNA viruses as the origin of eukaryotic replication proteins". J Virol 74 (15): 7079–7084. doi:10.1128/JVI.74.15.7079-7084.2000. PMC 112226. PMID 10888648. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=112226.
- ↑ Bell PJ (November 2006). "Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus". J. Theor. Biol. 243 (1): 54–63. doi:10.1016/j.jtbi.2006.05.015. PMID 16846615.
- ↑ de Roos AD (2006). "The origin of the eukaryotic cell based on conservation of existing interfaces". Artif Life 12 (4): 513–523.. doi:10.1162/artl.2006.12.4.513. PMID 16953783.





