Углерод
| Углерод | |
|---|---|

Углерод встречается как:
| |
|
Свойства атома | |
| Атомная масса (молярная масса) |
12,011 (природная смесь нуклидов) а. е. м. (г/моль) |
| Радиус атома | 77(sp³), 73(sp²), 69(sp) пм |
| Энергия ионизации (первый электрон) |
1086,5 (11,25) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s22p2 |
| Химические свойства | |
| Ковалентный радиус | 77 пм |
| Радиус иона | 16 (+4e) 260 (-4e)пм |
| Электроотрицательность (по Полингу) |
2,55 |
| Электродный потенциал | — |
| Степени окисления | 4, 2, -4 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,25 (графит) г/см³ |
| Удельная теплоёмкость | 8,517Дж/(K·моль) |
| Теплопроводность | 1,59 Вт/(м·K) |
| Температура плавления | (1 atm) 3800 (графит) K,
(3527 °C, 6381 °F) |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 4300 K(4027°C,7281°F) |
| Теплота испарения | n/a кДж/моль |
| Молярный объём | 5,3см³/моль |
| Кристаллическая решётка простого вещества | |
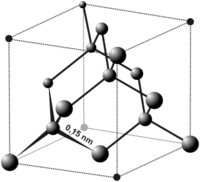
| Структура решётки | гексагональная (графит), кубическая (алмаз) |
| Период решётки | n/a Å |
| Отношение c/a | 1860,00 |
| Температура Дебая | n/a K |
Углерод — химический элемент с атомным номером 6 в периодической системе, обозначается символом С (лат. Carboneum), неметалл.
Истрия названия и открытия[править | править код]
Углеро́д в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны алмаз и графит. Элементарная природа углерода установлена А. Лавуазье в конце 1780-х годов.
Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar — огонь. Этот же корень в латинском cremare — гореть, а возможно, и в русском «гарь», «жар», «угореть» (в древнерусском «угорати» — обжигать, опалять). Отсюда — и «уголь».
Изотопы углерода[править | править код]
Подробнее в статье изотопы углерода Природный углерод состоит из двух стабильных нуклидов — 12С (98,892 %) и 13С (1,108 %)и одного радиоактивного нуклида 14С (β-излучатель, Т½= 5730 лет), состредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14N (n, p) 14C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
Аллотропные модификации углерода[править | править код]
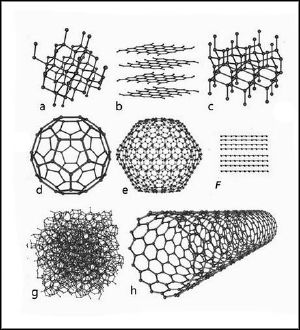
a: алмаз,
b: графен,
c: графит
d: фуллерены — букибол C60,
e: фуллерены C540,
F: карбин,
g: технический углерод,
h: углеродные нанотрубки.
- графит,
- алмаз,
- карбин,
- лонсдейлит,
- фуллерены,
- углеродные нанотрубки,
- графен,
- аморфный углерод;
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
- тетраэдрическая, образуется при смешении одного s- и трех p-электронов (sp³-гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
- тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp²-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
- дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз[править | править код]
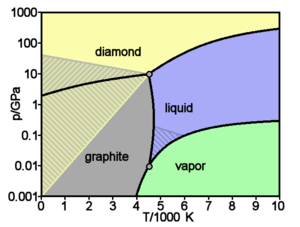
Основные и хорошо изученные кристаллические модификации углерода — алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. ΔН0 перехода — 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3 780 K. Жидкий углерод существует только при определенном внешнем давлении. Тройные точки: графит-жидкость-пар Т = 4130 K, р = 12,5 ГПа. Прямой переход графита в алмаз происходит при 3000 K и давлении 11—12 ГПа.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/ттс), плотность 3,51 г/см³, т. е. такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)[править | править код]
В 1980-е гг. в СССР было обнаружено, что в условиях динамического нагружения углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких матералах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ с значительным отрицательным кислородным балансом, напрмер смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин[править | править код]
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или ССl4 в низкотемпературной плазме.
Фуллерены и углеродные нанотрубки[править | править код]
Углерод известен также в виде кластерных частиц С60, С70 и подобных (фуллерены), а также графенов и нанотрубок.
Аморфный углерод[править | править код]
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Нахождение в природе и получение[править | править код]
Руды и минералы[править | править код]
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки).
Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов — в почву и в виде СО2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Мировые ресурсы[править | править код]
Общие мировые ресурсы угля, которое находилось в недрах до того, как его начали добывать, оцениваются суммарной величиной более 15 000 млрд. т. Из них примерно половина доступна для добычи.
Основная масса мировых ресурсов угля находится в Азии и сосредоточена главным образом в Китае и России. Эти страны входят в число крупнейших производителей угля. Северная Америка и Западная Европа занимают соответственно второе и третье места по ресурсам угля и являются весьма крупными производителями угля.[1]
Производство чистого элемента[править | править код]
Уголь или обычный древесный уголь - это химический элемент углерод (С). Его можно добыть при очистке недогоревших головешек из костра или купить активированный уголь в аптеке. Активированный уголь - это особым образом обработанный древесный, каменный или другой уголь, который обладает большой поглотительной, обесцвечивающей способностью. Обработка обыкновенно производится водяным и парами различных химических веществ. Регенерация активированного угля кислотами производится в зоне перегретого водяного пара. Чистый уголь применяется для поглощения различных лёгких в струе летучих газов, а также для обесцвечивания и дезодорации различных веществ и растворителей.[2]
Физические свойства[править | править код]
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими и химическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. Основные физические свойства собственно углерода смотри в таблице.
Химические свойства[править | править код]
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения[править | править код]
Углерод реагирует со многими элементами с образованием карбидов.
Продукты горения — оксид углерода CO и диоксид углерода СО2. Известен также неустойчивый оксид С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды. Графит и аморфный углерод начинают реагировать с Н2 при 1200 °C, с F2 — соответственно 900 °C.
CO2 с водой образует слабую угольную кислоту — H2CO3, которая образует соли — Карбонаты. На Земле наиболее широко распространены карбонаты кальция (мел, мрамор, кальцит, известняк и др. минералы) и магния (доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в среде N2 образуется циан, при высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту. С серой углерод дает сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует карбиды. Важна в промышленности реакция углерода с водяным паром: С + Н2О = СО + Н2 (см. Газификация твердых топлив). При нагревании углерод восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
Органические соединения[править | править код]
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Применение[править | править код]
Металлургия[править | править код]
Ядерная энергетика[править | править код]
Электроника[править | править код]
Медицина[править | править код]
Оптика[править | править код]
Прочие области применения[править | править код]
Цены[править | править код]
Изотопы[править | править код]
Биологическая роль[править | править код]
См.также[править | править код]
Литература[править | править код]
Ссылки[править | править код]
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
| Iа | IIа | IIIб | IIIб: лантаноиды и актиноиды и Суперактиноиды | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
| Аллотропные формы углерода |
| Алмаз | Графен | Графит | Карбин | Технический углерод | Углеродные нанотрубки | Фуллерены |