Аммиак
Аммиак
- Отн. молек. масса:
- 17,0306 а.е.м.
- Молярная масса:
- 17,0306 г/моль
- Плотность:
- 0,6942 г/см³694,2 кг/м³ <br />
Термодинамика:
- Температура плавления:
- -77,73 °C195,42 K <br />-107,914 °F <br />351,756 °R <br />
- Температура кипения:
- -33,34 °C239,81 K <br />-28,012 °F <br />431,658 °R <br />
- Критическая точка, температура:
- 132,25 °C405,4 K <br />270,05 °F <br />729,72 °R <br />
Образование и разложение:
- Энтальпия образования (ст. усл):
- -45,94 кДж/моль-45940 Дж/моль <br />
Растворимость:
- Растворимость:
- 899 г/л (при 0°C)
- pKa:
- основность 4,75
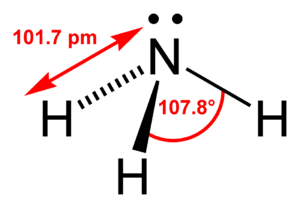
Аммиа́к — NH3, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика - около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды. Молекула аммиака имеет вид тетраэдра с атомом азота в вершине. При неспаренных h-электронах атомы азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода. Кроме того, у атома азота есть неподелённая пара электронов. В жидком аммиаке молекулы связаны между собой водородными связями. Этим объясняется сравнительно высокая температура кипения и высокая теплота испарения аммиака. Однако прочность этих связей в жидком аммиаке существенно ниже, чем у воды, поэтому вязкость, например, жидкого аммиака в 7 раз меньше вязкости воды.
Химические свойства[править | править код]
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония: NH3 + H+ = NH4+ С кислотами даёт соответствующие соли аммония: NH3 + HNO3 = NH4NO3 Водный раствор аммиака ("нашатырный спирт") имеет слабощелочную реакцию из-за протекания процесса NH3 + H2O = NH4+ + OH- С галогеноалканами вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов): NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония) С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами - основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование). Аммиак также является очень слабой кислотой (более слабой, чем вода), способен образовывать с металлами соли - амиды. Аммиак горит в атмосфере кислорода, давая воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты. 4NH3 + 3O2 → 2N2 + 6H20 Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества - галогениды азота (хлористый азот, иодистый азот). Окислением аммиака гипохлоритом натрия в присутствии желатина получают гидразин. При 1000°C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород.
Биологическая роль[править | править код]
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Аммиак считается токсичным соединением для организма человека, поэтому его большая часть в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак. Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название "восстановительное аминирование". Таким образом из щавелевоксусной кислоты получается аспарагиновая, из α-кетоглутаровой - глутаминовая, и т.д.
Физиологическое действие[править | править код]
Аммиак ядовит. ПДК = 20 мг/м3. Жидкий аммиак вызывает сильные ожоги. При содержании в воздухе 0,5% по объему аммиак сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхательные пути. При хроническом отравлении — расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
Применение[править | править код]
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя. В холодильной технике используется в качестве холодильного агента
Получение[править | править код]
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Это так называемый процесс Габера (немецкий физик, разработал физико-химический основы метода, реализацию способа предложил немецкий химик Карл Бош). Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле Шателье — Брауна, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования. Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ. Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления. Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O. Для осушения аммиака его пропускают через смесь извести с едким натром.

|
Текущая версия статьи о неорганическом соединении. Помогите Традиции, исправьте и дополните её. |
| Соединения азота | ||
|---|---|---|
|
Фторид азота(III) - NF3 Тетрафторгидразин - N2F4 Дифтордиазин - N2F2 Азид фтора - N3F Хлорид азота(III) - NCl3 Азид хлора - N3Cl Бромид азота(III) - NBr3 Азид брома - N3Br Иодид азота(III) - NJ3 Азид иода - N3J |  | |