Кератины
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи - такие структуры, как шерсть, волосы, ногти, рога носорогов, перья и рамфотека клюва птиц и др.
Согласно новой номенклатуре кератинов[1], в это семейство входят также цитокератины, образующие наиболее прочные элементы внутриклеточного цитоскелета эпителиальных клеток.
История изучения[править | править код]
Исследования α-кератинов стало важнейшим этапом в создании современных представлений о значительно более сложных глобулярных белках.
Первые рентгеноструктурные исследования белков начались в 1930-х годах. Английский физик и молекулярный биолог Уильям Астбери (William Astbury) показал, что дифракционная картина от пучка рентгеновского луча, направленного на волос или шерстяную нить (в основном состоящих из α-кератинов), содержит расположенные вдоль оси волоса повторяющиеся структурные единицы длиной около 0,54 нм (нанометров). В результате наблюдений было высказано предположение о том, что полипептидные цепи в белках этого семейства не вытянуты полностью, а скручены или свернуты каким-то регулярным образом[2].
Структура белка[править | править код]
По вторичной структуре белка семейство кератинов разделяется на две группы:
- α-кератины имеют конформацию в виде плотных витков вокруг длинной оси молекулы (α-спираль); эти кератины являются основой волос (включая шерсть), рогов, когтей и копыт млекопитающих.
- β-кератины, более твёрдые и имеющие форму несколько зигзагообразных полипептидных цепей (т. н. β-листы); эти кератины обнаружены в когтях и чешуе рептилий, в их панцирях ( у черепах), в перьях, клювах и когтях птиц, в иглах дикобразов.
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей. Молекулярная масса — от 10 до 50 кДа. Периодичность в чередовании аминокислотных остатков в молекулах отсутствует.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Свойства[править | править код]
Характерной особенностью α-кератинов является их полная нерастворимость в воде при pH 7,0 и физиологической температуре. Данное свойство частично обусловлено тем, что в состав молекулы входит большой процент гидрофобных аминокислотных остатков (фенилаланин, изолейцин, валин, метионин и аланин). В силу конформации белка R-группы этих остатков направлены к внешней стороне спиралевидной структуры молекулы.
Молекулярная биология и биохимия[править | править код]
Использование кератинов в организме зависит от надмолекулярного строения, которое зависит от свойств каждого полипептида, которые, в свою очередь, зависят от состава и последовательности аминокислот. Альфа-спирали, бета-листы и дисульфидные связи важны и для создания правильной конформации активных глобулярных белков, таких как ферментов, многие из доменов которых работают относительно независимо; в случае же кератинов они играют самую важную роль в образовании структуры.
Кератины кодируются генами большого мультигенного семейства (в геноме человека известны на хромосомах 11, 12 и 17)[3].
Пары[править | править код]
| A (нейтральные-основные) | B (кислые) | Вид |
| keratin 1, keratin 2 | keratin 9, keratin 10 | stratum corneum, keratinocytes |
| keratin 3 | keratin 12 | cornea |
| keratin 4 | keratin 13 | stratified epithelium |
| keratin 5 | keratin 14, keratin 15 | stratified epithelium |
| keratin 6 | keratin 16, keratin 17 | squamous epithelium |
| keratin 7 | keratin 19 | ductal epithelia |
| keratin 8 | keratin 18, keratin 20 | simple epithelium |
| A (neutral-basisch) | B (sauer) | Vorkommen |
|---|---|---|
| CK 1, 2 | CK 9, 10 | mehrschichtig-verhornendes Epithel (Epidermis) |
| CK 3 | CK 12 | Hornhaut (Cornea) |
| CK 4 | CK 13 | mehrschichtig-unverhorntes Epithel |
| CK 5 | CK 14, CK15 | Basalzellen komplexer Epithelien sowie Myoepithelzellen |
| CK 6 | CK 16, CK17 | mehrschichtig-unverhorntes Plattenepithel, Proliferation |
| CK 7 | CK 19 | einschichtiges Epithel, luminale Drüsenzellen |
| CK 8 | CK 18, CK20 | einschichtiges Epithel, luminale Drüsenzellen |
The entries KRT23, KRT24, KRT25, KRT26, KRT27, KRT28, KRT31, KRT32, KRT33, KRT33A, KRT34, KRT35, KRT36, KRT37, KRT38, KRT39, KRT40, KRT71, KRT72, KRT73, KRT74, KRT75, KRT76, KRT77, KRT78, KRT79, KRT8, KRT80, KRT81, KRT82, KRT83, KRT84, KRT85 and KRT86 have been used to describe keratins past 20.[1]
Глицин и аланин[править | править код]
В кератинах содержится высокий процент самой маленькой аминокислоты — глицина, чей радикал состоит всего из одного атома водорода; следующая самая маленькая аминокислота — аланин, с радикалом, состоящим из маленькой и незаряженной метильной группы. В случае бета-слоёв это позволяет образовываться пространственно упорядоченным водородным связям между амино- и карбокси-группами. Молекулы фиброзного кератина могут закручиваться друг вокруг друга, образуя промежуточные филаменты.
Ограниченное внутреннее пространство является причиной того, что тройная спираль неродственного кератину белка коллагена, содержащегося в коже, хрящах и костях, также имеет большое содержание глицина. Соединительнотканный белок эластин тоже содержит большой процент и глицина, и аланина. Фиброин шёлка тоже может содержать от 75 до 80 % глицина и аланина b 10—15 % аминокислоты серина.
Дисульфидные связи[править | править код]
В дополнение к меж- и внутримолекулярным водородным связям, в кератинах содержится большое количество дисульфидных связей, образованных при участии серосодержащей аминокислоты цистеина, которые придают дополнительную прочность и упругость кератину постоянными термостабильными межмолекулярными связями. Человеческие волосы на 14 % состоят из цистеина. Едкие запахи горящих волос или резины (в которой при вулканизации тоже образуются дисульфидные связи) вызываются компонентами серы. Прочные дисульфидные связи делают кератин нерастворимым, кроме тех случаев, когда компоненты подвергаются электролитеческой диссоциации или окислительно-восстановительным реакциям.
В более упругих и эластичных кератинах волос меньше дисульфидных связей, чем в кератинах когтей, копыт и гомологичных им структур, которые более тверды. Альфа-кератины волос состоят из альфа-спиральных отдельных белковых цепочек с постоянными водородными связями. В бета-кератинах птиц и рептилий есть бета-слои, которые затем стабилизируются и затвердевают с помощью дисульфидных связей.
Ороговевание и его функции[править | править код]
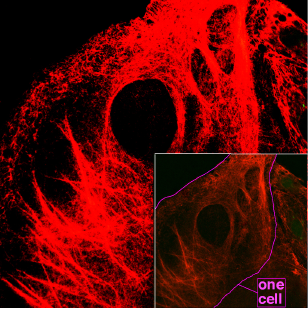
Принято считать, что кератины можно поделить на «твёрдые» и «мягкие», или «цитокератины», образующие цитоскелет клетки (см. рис.) и другие кератины. Кератины в эпителиальных клетках образуют промежуточные филаменты. Кератин формирует нитевидные полимеры, начиная с димеризации; затем происходит сборка димеров в тетрамеры и октомеры, и, в конце концов, в субъединицы длинного филамента, способные образовывать длинные филаменты.
В течение процесса эпителиальной дифференцировки клетки эпидермиса кожи ороговевают. В конце концов ядра и цитоплазматические органоиды исчезают, обмен веществ прекращается, и наступает апоптоз клетки, когда она полностью кератинизируется (ороговевает).
Клетки эпидермиса содержат структурный матрикс кератина, который создаёт внешний водоупорный слой кожи и, совместно с коллагеном и эластином, придаёт коже упругость и прочность. Трение и давление заставляет клетки образовывать кератин в целях защиты в больших количествах, в результате чего возникают кожные наросты или мозоли. Кератинизированные клетки эпидермиса непрерывно отшелушиваются и замещаются (см. перхоть).
Роговые производные покровной системы (перья, ногти и др.) формируются за счёт более прочного соединения волокон кератина и более упорядоченного расположения содержащих его клеток; они формируются внутри специальных впячиваний эпителия (фолликулов) и могут регенерировать после линьки.
В других видах клеток, таких, как в живых клетках неороговевающих эпителиев, функцией кератина является механическая стабилизация цитоплазмы клетки против физического воздействия. С помощью кератиновых промежуточных филаментов клетки эпителиев соединяются с помощью десмосом и гемидесмосом, соответственно, друг с другом и с межклеточным веществом.
Функции кератинов в организме[править | править код]
Обладая механической прочностью и нерастворимостью, кератины являются одним из основных компонентов для производных элементов кожи животных, выполняющих защитную функцию. Значительную часть сухого веса наружного слоя кожи составляют α-кератины.
Эластичные α-кератины входят в состав волос, шерсти, ногтей, игл, роговых чехлов рогов, когтей и копыт млекопитающих. Чешуйки и когти пресмыкающихся (в том числе панцирь у черепах), а также перья, роговой чехол клюва и когти у птиц кроме α-кератинов содержат и более жёсткие β-кератины.
У членистоногих, например, ракообразных, β-кератины часто входят в состав экзоскелета вместе с хитином. Китовый ус китов-фильтраторов также состоит из кератина. Кератины могут присутствовать и в составе хитинофосфатных раковин многих плеченогих.
Кроме того, β-кератины формируют шёлковое волокно (которое на 60 % состоит из β-кератина фиброина) и паутину.
Использование[править | править код]
α-кератины, получаемые из отходов в мясной промышленности, используют для получения природных аминокислот.
См. также[править | править код]
Примечания[править | править код]
- ↑ а б Schweizer J, Bowden PE, Coulombe PA, Langbein L, Lane EB, Magin TM, Maltais L, Omary MB, Parry DA, Rogers MA, Wright MW (2006). "New consensus nomenclature for mammalian keratins". J Cell Biol. 174 (2): 169-174. DOI:10.1083/jcb.200603161. PMID 16831889. Ошибка цитирования Неверный тег
<ref>: название «pmid16831889» определено несколько раз для различного содержимого - ↑ Ленинджер А. Основы биохимии. — Мир, 1985. — Т. 1. — С. 168. — 367 с.
- ↑ Кератин / Словарь биотехнологических терминов
Литература[править | править код]
- Ленинджер А., Основы биохимии, пер. с англ., т. 1, М., 1985, с. 167-76, В. В. Баев.