Участник:Миг/Зрительная фототрансдукция
Зрительная фототрансдукция или Фототрансдукция в палочках и колбочках — физиологический процесс создания и трансформации биохимических нервных сигналов, при формировании оптического изображения в процессе зрения позвоночных животных. Процесс этот начинается от захвата фотонов сетчаткой глаза, и завершается формированием зрительных образов в зрительной коре головного мозга.[1]
Введение[править | править код]
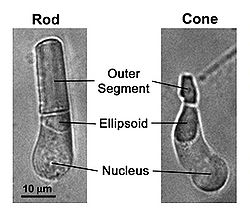
Формирование оптического изображение в процессе зрения у позвоночных животных связано с находящимися к сетчатке глаза колбочек (cone) и палочек (rod) и в то же время при зрении участвуют фотосенсоры ipRGC, расположенные в сетчатке вне фокальной поверхности, но непосредственно не формируют оптическое изображение, а участвуют в работе колбочек и палочек. Палочки специализированы для «низко-легкого» зрения. Они чрезвычайно чувствительны и могут сигнализировать поглощение одиночных фотонов. Колбочки обеспечивают видения дневного света (иллюстрация 1). Они намного менее чувствительны свету, чем палочки, но обладают более длительнным временным восприятием. Они также обеспечивают цветное зрение благодаря наличию нескольких типов колбочек с изменчивыми фотопигментами, чувствительных к различным спектральным лучам.
- Рис. 1. Светлопольные изображения фоторецептора палочки и фоторецепторов колбочки, изолированных от сетчатки саламандры. Фототрансдукция имеет место во внешней доле, в то время как эллипсоид плотно упакован mitochondria. Палочки ответственны за тусклое легкое видение, колбочки для видения яркого света.
Имеются большие достижения в понимании фототрансдукции палочки. Начиная с введения электрода всасывания, позволяющего производить запись техники при экспериментах в конце 1970-ых (Baylor и др., 1979a). Фоторецепторы человека, земноводных и относящиеся к млекопитающим (включая примата), могут быть использованы для исследоаний этим методом. Бычья сетчатка, с другой стороны, была любимой при подготовке к тому, чтобы изучить фототрансдукцию биохимиками из-за изобилия доступной ткани. Мышь, однако, стала более популярной моделью животных для исследования в прошлом десятилетии при помощи появившихся планируемых генных методов. Когда это объединено с электрофизиологией, генетика мыши обеспечивает непревзойденную власть в объяснении в естественных условиях функции ключевых белков фототрансдукции, большинство которых было выбито, сверхвыражено или видоизменено в колбочках, приводя к богатому объему информации на принципах, лежащих в основе увеличения, восстановления и адаптации фотоответов палочка/колбочка (Таблица 1, рис. 2,3).
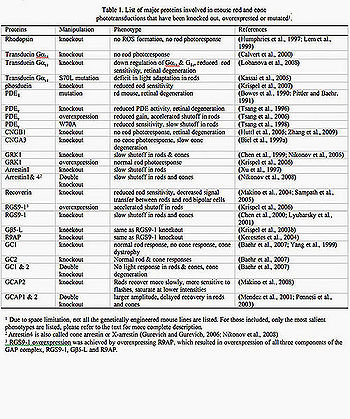
Таблица 1. Список главных белков, вовлеченных в палочке мыши и фототрансдукции колбочки, которые были выбиты, сверхвыражены или mutated1 1) из-за высокого ограничения, но не все генетически проектируемые линии мыши перечислены. Для включенных только перечислены самые существенные фенотипы (в тексте дано более полное описание). 2) Arrestin4 также называют колбочкой-arrestin или X-arrestin (Gurevich и Gurevich, 2006; Никонов и др., 2008) 3) сверхвыражение RGS9-1 было достигнуто сверхвыражением R9AP, который привел к сверхвыражению всех трех компонентов комплекса ПРОМЕЖУТКА, RGS9-1, G_5-L и R9AP.
Сначала даётся краткое описание структуры и развития фоторецепторов мыши, сопровождаемых резюме недавних исследований фототрансдукции палочки с акцентом на информацию, подбираемой от образцов мыши. В конце, будет упомянут недавний прогресс в обучающихся колбочках мыши.
Структура палочек и колбочек[править | править код]
Палочки составляют ~97 % фоторецепторов глаза мыши сетчатки глаза, колбочки — остальное (Картер-Доусон и LaVail, 1979). Фоторецепторы мыши подобны фоторецепторам примата в физических измерениях (Стол 2 и иллюстрация 2). Внешняя доля - приблизительно 1.4мкм в диаметре и 24мкм в длине для палочек, и, соответственно, приблизительно 1.2мкм. и 13мкм. для колбочек. Эти величины являются значительно меньшими, чем у фоторецепторов земноводных (иллюстрация 1), которые объясняют давнюю пользу физиологов для исследований последних.

- Таблица 2. Физические измерения внешней доли палочек мыши и колбочек Саламандра, а фоторецепторы примата включены для сравнения.
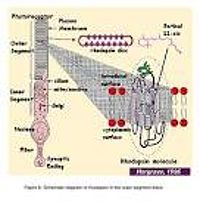
Палочки и колбочки имеют четыре первичных структурных/функциональных областей: внешняя доля, внутренняя доля, тело ячейки и синаптический терминал. Внешняя доля связана с внутренней долей через тонкую соединительную ресницу. Внешняя доля является заполненной плотным прозрачным веществом мембранных дисков (иллюстрации 2 и 3), разделённой промежутками в приблизительно в 28 нм. Диски несут визуальный пигмент опсин (разновидность фотопигментов «rhod-opsin» в палочках и разновидность фотопигментов колбочки «con-opsin» в колбочках)[5] и других компонентах трансдукции или как трансмембранные или периферийные мембранные белки (иллюстрация 3). Визуальный фотопигмент — самый насыщенный белок во внешней доле (мембране). Важность визуального пигмента как главного структурного компонента демонстрируется у мыши rhodopsin-нокаута, палочке, внешние доли которой не в состоянии сформироваться (Humphries и др., 1997; Лем и др., 1999). Фоторецепторы палочки этой мыши — выродившийся сопровождаемый представитель колбочек. Упаковочная плотность молекул пигмента на дисках необычно однородна поперек различных позвоночных разновидностей, содержашихся на площади ~25000 мм², соответствуя концентрации ~ 3mM (Harosi, 1975). Общее количество молекул пигмента во внешней доле может таким образом быть вычислено примерно от ее объема конверта. Плотный стек дисков очень увеличивает вероятность захвата фотона. Интересное различие между палочками и колбочками - это то, что диски палочки(за исключением возникающих дисков в основе внешней доли) полностью усвоены и поэтому физически отдельные от плазменной мембраны, тогда как диски колбочки остаются свёрнутыми плазменной мембраной. Открытые диски колбочки предлагают намного большую поверхностную область для быстрых потоков веществ между внешностью клетки и интерьером, по типу передачи хромофора для регенерации фотопигмента и быстрой динамики кальция в течение световой лёгкой адаптации.
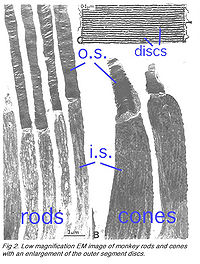
- Рис. 2. Низкое усиление изображений палочек и колбочек обезьяны с расширением внешних дисков (мембран) доли.
- Рис.3. Схематическая диаграмма rhodopsin во внешних дисках (мембран) доли.
Внутренняя доля фоторецепторов содержит endoplasmic сеточку и аппарат Golgi. Это также упаковано mitochondria, близко, смежно с внешней долей (иллюстрации 2 и 3), чтобы обеспечить высокий спрос на метаболическую энергию, связанную с фототрансдукцией. Все белки, предназначенные для внешней доли, должны пройти через узкую зону соединительной ресницы между внешним и внутренними долями.
Синаптический терминал передает световой сигнал к нейронам второго заказа в сетчатке: к биполярным и горизонтальным ячейкм. В темноте есть устойчивый внутренний поток («темный поток») через проводимость катиона на мембране внешней доли (Hagins и др., 1970), деполяризуя палочку или колбочку и поддерживая устойчивый синаптический выпуск глутамата. Свет закрывает эту проводимость катиона («светочувствительная« проводимость, состоя из cGMP-gated каналов) служит, чтобы остановить темный поток и произвести мембранную гиперполяризацию как ответ. Эта гиперполяризация уменьшает или заканчивает темный глутаматный выпуск. Сигнал далее обработывается другими нейронами в сетчатке прежде, чем передаётся в высшие отделы зрительных центров в мозге.
Визуальные пигменты палочек и колбочек мыши[править | править код]
Мышь имеет единственный пигмент палочки родопсин (rhodopsin]], и два пигмента колбочек: пигменты S-(синих) и пигменты M.-(зелёных) колбочек, с максимальной спектральной чувствительностью в 360 нм и 508 нм, соответственно. Мышь необычна в том индивидуальном показе колбочек и S-и М. пигментов колбочек, когда уровень пигмента М. колбочки имеет градиент уменьшения от спинной до брюшной сетчатки (Applebury и др., 2000).
Единственный пигмент палочек родопсин или род-опсин(«Мышь rhodopsin») и пигменты колбочек кон-опсины принадлежит семье высшего качества соединенных рецепторов Белка г (GPCRs). С высокой разрешающей способностью (2.8 Å) была определена трехмерная структура государства основания бычьего rhodopsin в 2000 Palczewski и др. (иллюстрация 9b) (Palczewski и др., 2000; Stenkamp и др. 2002). Будущий вызов должен решить структуру пигментов конуса, которая намного более непостоянна чем rhodopsin.


- Иллюстрация 9. Структурная модель бычьего rhodopsin, показ семи трансмембранных компонентов и участка приложения в сетчатке глаза. Семь ТМ helices показывают пронумерованные серые коробки, и β-strands - берега показывают стрелки. Соответствующие диапазоны остатка этого ТМ helices следующие: я, 35-60; II, 71-100; III, 107-137; IV, 151-173; V, 200-225; VI, 247-277; VII, 286-306; VIII, 310-324. Расплющенная линия указывает двусернистое обязательство C110-C187, расположенное в интерфейсе между областями EC и ТМ. Переизданный от (Rader и др., 2004)
- Иллюстрация 9b. Пара стерео кристаллической структуры rhodopsin. От Stenkamp и др. 2002.
Зрительные пигменты от большинства позвоночных разновидностей, включая млекопитающих, используют 11-cis-retinal (обозначено A1), в то время как те от многих животных на основе воды используют 11-cis-3,4-dehydroretinal (обозначено A2), как их естественный лиганд (Мосты, 1972; Dartnall и Lythgoe, 1965; Wald, 1939). Джордж Валд сначала идентифицировал витамин А в сетчатке (Wald, 1935) и позже показал, как это функционирует со светом, который формирует молекулярное основание видения (Нобелевская премия 1967). Хромофор ковалентно связан через Schiff-основное редактирование с сохраненным остатком лизина (K296 в относящемся к млекопитающим rhodopsin) в седьмой трансмембранной спирали (иллюстрация 9 и 9b). В темноте, 11-cis-retinal действует как обратный участник состязания, чтобы захватить rhodopsin в бездействующей среде, предотвращая свободный опсин от формирования каскада фототрансдукции. Роль "захвата" 11-cis-retinal как ясно демонстрировалась в RPE65-пустых мышах. RPE65 функционирует как isomerase в визуальном цикле RPE, который является важным для того, чтобы восстановить пигменты колбочки и палочки. Rpe65-/-сетчатка имеет фактически Номер 11-cis-retinal (Редмонд и др., 1998). Фоторецепторы палочки ухудшаются медленно из-за постоянной активации фототрансдукции большим количеством свободного у колбочек opsin. Это вырождение может быть предотвращено, удаляя transducin α-subunit, который блокирует активацию вниз по течению каскад (Woodruff и др., 2003). В отдельном эксперименте, K296 видоизменен к глутаминовой кислоте, производя opsin без обязательного хромофоромного участка (Литий и др., 1995). Хотя K296E opsin учредительно активизирует transducin в пробирке, учредительная деятельность мутанта opsin в естественных условиях была выключена из-за фосфорилирования rhodopsin киназой, сопровождаемой arrestin, связывающим (см. завершение R*).
Даже с приложенным 11-cis-retinal, rhodopsin иногда подвергается непосредственной (тепловой) активации в темноте, производя ответы, идентичные вызванные фотонами (Baylor и др., 1980). Непосредственная активация зрительных молекул пигмента устанавливает окончательный предел зрительной чувствительности (Aho и др., 1988; Autrum, 1943.; Барлоу, 1956; Donner, 1992). В палочке жабы, норма тепловой активации rhodopsin была измерена, чтобы быть 0.031 в 22 (C, соответствуя среднему числу ждут из 2000 лет непосредственной активации данных rhodopsin молекулы, чтобы произойти, основанные на в общей сложности 2х молекулы rhodopsin в ячейку (Yau и др., 1979). Эта большая стабильность позволяет палочкам упаковать много rhodopsin молекул к дискам палочки, чтобы увеличить его способность захвата фотона, сохраняя темноту с низким шумам. В палочках мыши дикого типа, довольно трудно измерить дискретный шум, являющийся результатом тепловой активации rhodopsin из-за относительно маленькой амплитуды ответа единственного фотона. Однако, измерение было достигнуто в GCAPs-/-прутах (Ожоги и др., 2002), и ответ единственного фотона которого - почти в пять раз больше, чем тот из дикого типа в результате устранения Приблизительно --установленная отрицательная обратная связь на guanylate циклазе (см. позже). Норма — ~0.012 при 36℃. Это соответствует и связано с ретиномоторной реакцией фоторецепторов, которая в последнее время на опытах показала о нечувствительности палочек к дневному освещению, к цветному зрению. А также , что колбочки в зависимости от содержания разновидностей пигмента кон-опсина делятся на колбочки-S, колбочки-M, колбочки-L (синие, зелёные, красные).
Фотопигменты палочек и колбочек[править | править код]
Фотопигменты палочек[править | править код]
Должно быть упомянуто, что вопрос темного шума в видении имел длинную интеллектуальную историю с точки зрения неврологии системы и psychophysics. Уже 1940-ые и 1950-ые, Hecht и Барлоу оценили количество "темного света" в человеческих палочках, основанных на психофизических экспериментах (Барлоу, 1957; Hecht и др., 1942). Больше чем 30 лет спустя, Baylor и коллеги использовали пипетку всасывания, делающую запись техники на палочках примата, чтобы демонстрировать что очень низкий quantal шум от rhodopsin, соответствуя ~ 0.01 случая при 36℃ в темноте (Baylor и др., 1984; Schneeweis и Schnapf, 2000), действительно соответствует человеческому психофизическому scotopic порогу. Количественное соглашение между quantal шумом, измеренным от единственных палочек, что это имело размеры в человеческой психофизике, считался крупным достижением в области видения и замечательной конвергенции между физиологией клетки и человеческой psychophysics/system неврологии — цель современной неврологии в конце концов!
Красный фотопигмент колбочки является намного более склонным к непосредственной изомеризации, чем rhodopsin (Кефалов и др., 2003; Rieke и Baylor, 2000), но трудно измерить норму от родных копбочек (Кефалов и др., 2003). Выражая человеческий красный пигмент колбочки transgenically в GCAPs-/-палочек, норма человеческого красного пигмента колбочки, как находили, была удивительно низкой в ~10(молекулярная норма постоянные ~1.35 x ) (Марихуана и др., 2008), почти в 1000 раз ниже, чем полный темный шум трансдукции, что получено предварительно в конусах примата (Schnapf и др., 1990; Schneeweis и Schnapf, 1999). Таким образом, подавляющее количество темного шума в примате при образование красной колбочки происходит не из непосредственной изомеризации пигмента, но наиболее вероятно от учредительной деятельности по направлению вниз по течению шагов фототрансдукции, типа phosphodiesterase (Holcman и Korenbrot, 2005).
Молекулярная норма, постоянная для тепловой изомеризации человеческого красного пигмента конуса A2 была настроена при ~5.6 x выражая человеческий красный пигмент колбочки в палочках Xenopus (Кефалов и др., 2003). Так как млекопитающие используют хромофор A1, A1, красный пигмент колбочки является возможно в 40 раз менее склонным к непосредственной изомеризации, чем форма A2 (Марихуана и др., 2008). Это вероятно происходит вследствие того, что хромофор A2 имеет дополнительное двойное обязательство в β-ionone кольце, которому предложили понизить барьер энергии для изомеризации (Мосты, 1967). Следовательно, это вводит красное изменение в поглощении (Donner и др., 1990) и уменьшает тепловую стабильность пигмента A2. Случайно, A1 rhodopsin, как находили, был в 30 раз более устойчивым чем A2 rhodopsin, довольно подобным образом обнаруженного красного пигмента колбочки (Крыло-Laurila и др., 2007). Что еще более важно в отличие от этого в более низких позвоночных животных, типа саламандры, где красный пигмент колбочки A2 является достаточно шумным, чтобы наложить потенциал adaptational влияния на колбочки даже в темноте (Кефалов и др., 2003; Кефалов и др., 2005; Rieke и Baylor, 2000), A1 красный пигмент колбочки (и аналогично для зеленых и синих пигментов колбочки) у приматов и по-видимому других млекопитающих должны быть достаточно тихими, чтобы иметь едва любое влияние adaptational на чувствительность колбочки. Другими словами, намного более низкая абсолютная чувствительность колбочек, относящаяся к млекопитающим, по сравнению с относящимися к палочкам млекопитающих, кажется, возникает не из quantal шума в пигментах непосредственно, а от других шагов фототрансдукции (Мельник и др., 1994; Nakatani и Yau, 1989; Tachibanaki и др., 2007). Это может объяснить, почему у приматов красные, зеленые и синие колбочки в отличие от их земноводных копий (мама и др., 2001; Перри и McNaughton, 1991), все имеют подобную чувствительность независимо от их различия в зрительных пигментах (Schnapf и др., 1990).
Фотоотбеливание бычьего rod-opsina[править | править код]

- Иллюстрация 10. Фотоотбеливание бычьего rhodopsin. После фотона поглотительное и электронное возбуждение, быстрая изомеризация хромофора приводит к формированию ряда промежуточных государств rhodopsin. Это называют "отбеливанием", потому что rhodopsin теряет его цвет. Промежуточные государства были идентифицированы и низко-температурной и решенной временем спектроскопией. Пиковая спектральная чувствительность каждого государства была обозначена. Британский институт стандартов, обнаруживал фиолетовое смещение промежуточное звено. Измененный от Волфганга Бера.
Поглощение фотона 11-cis-retinal вызывает изомеризацию СНГ-к-сделке смолоподобного (Hubbard и Wald, 1952; Wald, 1951). Уже в 1950-ых 1930-ых, ученые зрения знали, что rhodopsin отбеливает постепенно по промежуточным звеньям, которые были недолги при температуре комнаты, но все же устойчивы в низких температурах (Lythgoe и Quilliam, 1938; Wald, 1938; Wald и др., 1950) (иллюстрация 10). Hubbard и Kropf измерили "промежуточные звенья отбеливания (смесь lumirhodopsin и metarhodopsin)" спектрофотометрией при -17℃ (Hubbard и Kropf, 1958). Фотоизомеризация быстро преобразовывает лиганд от мощного обратного участника состязания до мощного участника состязания, приводя к формированию ряда спектрально отличных промежуточных звеньев rhodopsin в заказе bathorhodopsin, lumirhodopsin, metarhodopsin я (Мета I), и metarhodopsin II (Мета II) в пределах нескольких миллисекунд (рассмотренный в Okada и Palczewski, 2001) (иллюстрация 10). Мета II - активная форма rhodopsin (R *), который в свою очередь распадается к бездействующей Мете III. Мета ВТОРОЕ государство фотопигмента колбочки распадается в 50 раз более быстро, чем тот из rhodopsin (Imai и др., 1997; Kuwayama и др., 2005; Shichida и др., 1994). Несмотря на это различие, rhodopsin и трансгенный красный пигмент колбочки, и наоборот, сигнализируют тождественно вниз по течению, сравнимый бок о бок с распадом в палочке Xenopus или колбочке (Кефалов и др., 2003). То же самое было найдено для rhodopsin и трансгенного красного пигмента колбочки в палочке мыши (Марихуана и др., 2008). Таким образом, мало того, что палочка и пигменты колбочки взаимодействуют данный transducin, киназа пигмента и arrestin количественно идентичными способами, но отключение, установленное киназой пигмента и arrestin также предшествует Мете, ВТОРОЙ распад палочки и пигментов колбочки, отдавая распад Меты II "без оценки ограничения" при нормальных условиях (см. завершение R*).
Решение протонного механизма передачи сигнала[править | править код]
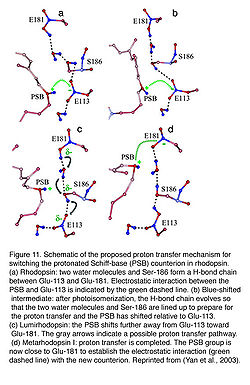
- Иллюстрация 11. Схемное решение предложенного протонного механизма передачи cигналов, чтобы переключать присоединенную протон Schiff-основу (PSB) противоион в rhodopsin. (a) Rhodopsin: две водных молекулы и Сер 186 формируют цепь H-обязательства между Glu-113 и Glu-181. Электростатическое взаимодействие между PSB и Glu-113 обозначено зеленой расплющенной линией. (b) Обнаружение фиолетового смещения промежуточного звена: после фотоизомеризации, развивается цепь H-обязательства так, чтобы две водных молекулы и Сер 186 были выровнены до, подготовки к протонной передаче, и PSB перемещение относительно Glu-113. (c) Lumirhodopsin: PSB перемещается еще дальше от Glu-113 к Glu-181. Серые стрелки указывают возможную протонную тропу передачи. (d) Metarhodopsin я: протонная передача закончена. Группа PSB - теперь близко к Glu-181, чтобы установить электростатическое взаимодействие (зеленая расплющенная линия) с новым противоионом. Переизданный от (Yan и др., 2003).
Колбочка сетчатки глаза поглощает максимально в УЛЬТРАФИОЛЕТОВОМ ДИАПАЗОНЕ (Ультрафиолетовое излучение) долины волн (Макс ~380 нм), когда в решении участвует обязанный opsin в режиме неприсоединенного протона. Поглощение перемещается в видимую область, когда к Schiff-основе (СУРЬМА) присоединен протон. Как другие позвоночные пигменты с присоединенным протоном у мыши rhodopsin и пигментом М. колбочки (кон-опсин). С другой стороны, пигмент Булочки мыши с неприсоединенным протоном, показывая его поглощение в УЛЬТРАФИОЛЕТОВОЙ ОБЛАСТИ (Vought и др., 1999). Положительно заряженная Schiff-основа стабилизирована противоионом E113 (число остатка согласно мыши-rhodopsin) в rhodopsin и М. пигмент колбочки (Nathans, 1990; Palczewski и др., 2000; Sakmar и др., 1989; Zhukovsky и Oprian, 1989). Активация Rhodopsin вовлекает "механизм" выключателя противоиона, в котором E181 определил местонахождение во внеклеточной петле II передач протона через сеть водородную-хранящуюся-на-таможенных-складах к первичному противоиону, E113, в течение формирования Меты I. Поэтому, E181 заменяет E113 как противоион, чтобы стабилизировать присоединенную протон Schiff-основу в стадии перехода перед ее возможным deprotonation (Yan и др., 2003) (иллюстрация 11).
Поскольку у пигмента Булочки (колбочки-S) мыши не присоединен протон, и соседний E113 нейтрален, возникают интересные вопросы: неужели случай protonation происходит в течение световой активации, и это вовлекает "механизм" выключателя противоиона? Замечено, что после изомеризации с 11 СНГ, Schiff-основа собрала протон в государстве Lumi от E108, чтобы стать, скоротечным процессом присоединения протона (Dukkipati и др., 2002), и происходит выключение противоиона от E108 (E113 в rhodopsin) к E176 (E181 в rhodopsin) в течение Lumi к Мете, которая очень аналогична с rhodopsin (Kusnetzow и др., 2004) (иллюстрация 12). Механизм фотоактивации пигмента Булочки, СУРЬМА SB → PSB (присоединяя протон Schiff-основа)SB → PSB (+):E108 (-) → PSB(+):E176(-) → SB делает видение (зрение) возможным в УЛЬТРАФИОЛЕТОВОЙ области. Таким образом, выключатель противоиона, скорее, является общим механизмом для активации всех зрительных пигментов сетчатки (например, колбочек и палочек.
Это значит, что фоторецепторы, например, колбочки чувствителны к спектральным лучам от УЛЬТРАФИОЛЕТОВЫХ до красных лучей!
Молекулярные модели Булочки (колбочки-S) мыши[править | править код]

- Иллюстрация 12. Молекулярные модели lumi (A) и Меты I (B) — промежуточные звенья Булочки (колбочки-S) мыши (спектр УЛЬТРАФИОЛЕТОВЫЙ), которая базировала пигмент при условии, что выключение преобразования противоиона происходит в течение lumi (противоион E108) к Мете I (противоион E176). Дипольные моменты обязательных остатков участка, μbs (M=μbs, где М — момент, b — вектор Бюргера, S — вектор площадки дисклинации, μ — модуль сдвига), даются в верхнем положении A и B, и дипольный вектор момента показывают при использовании красных-к-синему стрелок. Переизданный от (Kusnetzow и др., 2004).
Распад R* (активированный родопсин) в конечном счете приводит к уходу (всей сделки, относящейся к сетчатке глаза) от белка. Хромофор преобразуется со "всеми-сделкми" назад к 11-cis-retinal через каскад ферментативных реакций, названных зрительным циклом в смежном RPE, прежде, чем быть используемым снова для регенерации визуальных пигментов (например, см. обзор McBee и др., 2001).
Зрительный пигмент — главный структурный компонент палочек и колбочек. Не удивительно, что генетическое удаление у мыши rhodopsin, приводит к виду палочек без надлежащего формирования мембранной доли (Humphries и др., 1997; Лем и др., 1999). (У палочек отсутствует внешняя доля мембраны, которая есть у колбочек). Действительно ли, что половина — количество нормального rhodopsin достаточна, чтобы поддержать здоровое ПЗУ? В коэффициенте корреляции для совокупности+/- мышь, палочки должным образом сформированы несмотря только на половину нормального уровня присутствующего rhodopsin. Однако, прогрессивное умеренное вырождение палочек действительно происходит. Интересно, норма активации фотоответа коэффициента корреляции для совокупности+/- палочки - дважды палочки нормальных (Calvert и др., 2001). Объяснение этого наблюдения было первоначально предложено, чтобы более низкая rhodopsin концентрация уменьшила белок, толпящийся на мембране диска, таким образом увеличивая коэффициент распространения rhodopsin и его норму столкновения с трансдукцией (transducin). Такое обнаружение таким способом указало бы на диффузионное столкновение трансдукции с фотовзволнованным rhodopsin как ограничивающий норму шага в активации фотоответа палочки. Однако, Liang и др. впоследствии сообщили об этом, что палочки в коэффициенте корреляции для совокупности+/- мышь не полностью нормальны в этом, что rhodopsin существует в маленьких структурах, подобных плоту так же, как в больших и организованных паракристаллах (Liang и др., 2004). Кроме того, есть приблизительное 40%-ое сокращение объема ПЗУ, содержания rhodopsin и на 11-cis-retinal уровне в этих ячейках. Важно, что эти авторы сообщили, что наблюдаемое ускорение фототрансдукции в коэффициенте корреляции для совокупности+/- палочки не происходили из-за более низкой плотности rhodopsin не только на поверхности диска мембраны, но также в структурных изменениях в целом ПЗУ. А это значит, что палочки лишены возможности к быстрой фототрансдукции, а также к работе в условиях яркого света, высокой освещённости. В недавних исследованиях (см. Ретиномоторная реакция фоторецепторов) при микроскопии живых клеток палочек и колбочек среза сетчатки это доказано на снимках.
Завершение R*[править | править код]
Активизированный rhodopsin (R *) инактивирован двухступенчатым процессом. Сначала, R* — phosphorylated rhodopsin киназой (GRK1), который понижает деятельность R*. Во вторых, белок arrestin (Arr1) связывает с phosphorylated R *, увенчивая его остаточную деятельность (Kuhn и Wilden, 1987; Wilden и др., 1986).
Многократные остатки серина/треонина в C-терминале rhodopsin (шесть в мышах и семь в людях) обеспечивают участки фосфорилирования для GRK1. Пигменты колбочки имеют больше потенциальных участков фосфорилирования в C-терминале, чем rhodopsin. Например, человеческий красный пигмент колбочки имеет 10 таких участков. Даже при том, что биохимические эксперименты первоначально вскрыли, что rhodopsin — преобладающе phosphorylated только в одном остатке серина после легкого подвергания (Ohguro и др., 1995), и последующая регистрация от трансгенных палочек мыши, несущих мутации участка фосфорилирования показала, что восстанавливаемая дезактивация R* требует по крайней мере трех событий фосфорилирования (Mendez и др., 2000). Кроме того, все шесть участков должны быть phosphorylated для нормального снижения ответа, чтобы перейти в другое состояние.
Многократные события фосфорилирования также прежложили, что бы находиться в состоянии воспроизводимости ответов палочки на одиночные фотоны (Gibson и др., 2000; Hamer и др., 2003; Mendez и др., 2000). Несмотря на то, что события, произведенные одиночными молекулами являются стохастическими в природе, ответ палочки на одиночный фотон показывает замечательную воспроизводимость в амплитуде и форме (Baylor и др., 1979b; Rieke и Baylor, 1998; Whitlock и Ягненок, 1999). Составляя в среднем по многократным шагам отключения, интегрированная деятельность R* изменяет меньше, чем иначе управляемый единственным шагом. Эта гипотеза поддержана экспериментами, используя трансгенные палочки мыши, несущие мутации участка фосфорилирования (Doan и др., 2006). Авторы показали, что воспроизводимость ответа единственного фотона изменяется по градуируемой и систематической манере с числом, но не идентичностью, участков фосфорилирования. Каждый участок фосфорилирования обеспечивает независимый шаг в rhodopsin дезактивации и что, все вместе, эти шаги сильно управляют целой жизнью R*.
Намного меньше известно о роли участков фосфорилирования в пигментах колбочек. Единственные в естественных условиях эксперименты, которые были сделаны Кефаловым и др. (Кефалови др., 2003), показывали, что трансгенные палочки лягушки, выражающие человеческий красный пигмент колбочки всеми 10-ю предполагаемыми видоизмененными участками фосфорилирования дали длительный ответ. Это говорит о том, что активизированный пигмент колбочки подавлен подобным двухступенчатым механизмом отключения даже при том, что его активная целая жизнь намного короче, чем та же на базе rhodopsin.

- Иллюстрация 13. Форма ответа от единственного фотона у прутов мыши при нокауте вспышкой с несовершенным завершением R* на быстром (a) и медленные (b) весы времени. Вспышки поставляли в t = 0. (Любезность Мэри Э. Ожоги).
В дополнение к мутациям всего серина C-терминала и остатков треонина аланина (Mendez и др., 2000), фосфорилирование родопсина может также быть предотвращено, удаляя область C-терминала пигмента (Chen и др., 1995b) или удаляя GRK1 (Chen и др., 1999). Как ожидается, палочки от всех трех трансгенных линий мыши показали подобные свойства ответа от единственного фотона, с амплитудой, достигающей плато в два раза большим, чем от дикого типа и распадающегося основательно stochastically после длинного интервала в 3 - 5 секунд. GRK1 установленное фосфорилирование начинает уменьшать деятельность R* в ~100 мс после вспышки, потому что это - пункт времени, в котором трансгенный ответ начинает отклоняться от ответа ВЕСА (иллюстрация 13). Как упомянуто ранее, это было оценено в недавнем исследовании, что целая жизнь R* - ~80 мс (Krispel и др., 2006), предлагая, что закрепление arrestin происходит быстро после фосфорилирования пигмента. Поэтому, GRK1/arrestin был посредник, отключение происходит в прутах еще ранее чем быстрая Мета ВТОРОЙ распад пигмента конуса (Кефалов и др., 2003), который имеет заказ 1 s после вспышки (Imai и др., 1997; Kuwayama и др., 2002; Shichida и др., 1994). GRK1-установленное отключение вероятно случается еще быстрее в конусах (см. ниже).
Мышь и крыса необычны в этом, тот же самый GRK1 присутствует и в палочках и в колбочках. Во всех других изученных разновидностях, другая киназа пигмента (так называемая "киназа пигмента колбочки"), GRK7, присутствует в фоторецепторах колбочки (Rinner и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Weiss и др., 2001). Действительно, много разновидностей животных, включая человека, имеют и GRK1 и GRK7 в конусах. Это объясняет, почему пациенты Oguchi с дефектным геном GRK1 имеют нормальное дневное видение, тогда как GRK1-пустые мыши продлили фотоответы колбочки (Lyubarsky и др., 2000; Никонов и др., 2005). Интересно, GRK7 показывали, чтобы иметь значительно выше определенную деятельность чем GRK1 и, в рыбе, присутствует при намного более высокой концентрации в колбочках, чем GRK1 находится в палочках (Tachibanaki и др., 2005; Wada и др., 2006). Это различие было предложено как потенциальный механизм, лежащий в основе более быстрого отключения и более низкой чувствительности колбочек, чем палочек (рассмотренный в Tachibanaki и др., 2006).
Биохимические эксперименты предлагают, что GRK1 — установленное фосфорилирование R* регулируется recoverin (Rec) (Chen и др., 1995a; Kawamura, 1992, 1993; Klenchin и др., 1995), который принадлежит семье обязательных белков с кальцием. Гипотеза о том, что, когда внутриклеточная свободная Приблизительно2+ концентрация высока в темноте, Rec-приблизительно2+ связывает с GRK1 и запрещает фосфорилирование R*. Когда Приблизительно2+ концентрация уменьшается на свету, Приблизительно2+ отделяет от recoverin; следовательно, получающаяся близость между recoverin и GRK1 уменьшена, и его запрещение на фосфорилировании R* выпущено. Однако, этой гипотезе бросали вызов с размерами в пробирке, предлагающие, что степень фосфорилирования R* была незатронута легкой адаптацией и изменениями во внутриклеточном Приблизительно2+ [130]. Это противоречие было наконец улажено регистрацией от Rec-/- палочки мыши (Makino и др., 2004), который показал, что этот Rec-приблизительно2+ продлевает адаптировавшийся к темноте ответ вспышки и увеличивает чувствительность палочки к тусклому устойчивому свету, вероятно, запрещая фосфорилирование R* GRK1. Кроме того, Rec-/- палочки имели более быструю Приблизительно2+ динамику, указывая, что recoverin является существенным Приблизительно2+ буфером в ПЗУ.
Во втором шаге для дезактивации R *, arrestin обязывает с phosphorylated R* (R*-P) завершать с успехом его каталитическую деятельность. У мыши, ответы тусклой вспышки от палочек arrestin-нокаута (Прибытие-/-) мыши не отличаются очень от ответа дикого типа до ммомента его падающей фазы, когда восстановление достигает приблизительно на полпути назад к основанию (Ксу и др., 1997). Поэтому, фосфорилирование одно может уменьшить R *'s деятельность значительно. Ответ Прибытия-/- палочки в среднем оправляются в ~10 раз более медленно, чем ответ прутов, испытывающих недостаток rhodopsin фосфорилирование (иллюстрация 13), по-видимому отражая непрерывную деятельность phosphorylated Меты ВТОРОЕ государство R*, пока это не распадается к бездействующей Мете III. В прутах, испытывающих недостаток и GRK1 и arrestin (GRK1-/-Прибытие-/-), фаза активации и пиковая амплитуда ответа тусклой вспышки напоминают таковые из GRK1-/- палочки, но тогда GRK1 и arrestin (GRK1-/-Прибытие-/-) распадаются медленно со временем, постоянно подобный тому из Прибытия-/- ответ (Ожоги и др., 2006), отражая распад non-phosphorylated R. Таким образом кажется, что фосфорилирование не влияет на распад R*.
По крайней мере два соединённых варианта существуют для палочки arrestin: во всю длину (p48) и C-терминал обрезанная форма (p44) (Смит и др., 1994). P44 имеет более быстрый на-норме, чем p48 для того, чтобы связать R* и R*-P (Palczewski и др., 1994; Pulvermuller и др., 1997). Кроме того, p44 более эффективен чем p48 в выключении R* в пробирке (Langlois и др., 1996; Palczewski, 1994). Хотя p48 в ~10 раз более изобилен, чем p44, это перемещает от ПЗУ до остальной части ячейки в темноте, поэтому в значительной степени отсутствуя в адаптировавшемся к темноте ПЗУ (Broekhuyse и др., 1985; Mangini и Pepperberg, 1988; Philp и др., 1987; Whelan и McGinnis, 1988). Это поднимает интересный вопрос о ролях индивидуального isoforms arrestin в неповрежденных палочках. Выборочно выраженная двумя isoforms в палочках мыши, испытывающих недостаток в эндогенном arrestin, получалось, что оба isoforms могли подавить деятельность phosphorylated R* быстро. Однако, только p48 был в состоянии подавить деятельность non-phosphorylated R* (Ожоги и др., 2006).
Колбочки показывают их собственный arrestin, названный колбочка- arrestin или X-arrestin (Arr4) (Ремесло и Whitmore, 1995; Murakami и др., 1993). Удивительно, и от палочки и от колбочки формы arrestin существуют в колбочках мыши (Zhu и др., 2005). Arr1 в колбочках является в ~50 раз выше, чем тот из Arr4 (Никонов и др., 2008). Одиночная регистрация клетки колбочек мышей с одним или обоими arrestins выбила показы, что arrestin требуется для нормального состояния клетки.
Т.о. можно утверждать, что колбочки-S наряду с палочками функционируют в зоне фиолетово-синего спектра. При этом, при дневном освещении — работают колбочки, при слабом освещении — палочки (см. иллюстрация 13).
Модель фототрансдукции колбочки мыши[править | править код]
Недавно были достигуты существенные успехи в понимании трансдукции колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Учитывая огромный успех в изучении фототрансдукции палочки за счёт комбинации генетики мыши и электрода всасывания в посдеднее время, позволяющих делать запись в исследованиях при использовании мыши, данная методика стала образцовой системой для изучения фототрансдукции колбочки. Что до недавнего времени ограничивало исследования ЭРГА (т.к. процент колбочек в сетчатке мал (~3 %) и присущая недолговечность внешней доли (мембраны) (САЛАТ РОМЭН)).
Данное препятствие было наконец преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и не допускают более хрупким САЛАТОМ РОМЭН хорошо вовлекать ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ») фоторецептора колбочки, относящейся к сетчатке глаза пластине, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981) как ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый подготовленный вид мышей — с уменьшением в нервном лейциновом факторе транскрипции застежки - молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу (генетику) клетки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй — создание EGFP экспрессов в колбочках мыши, которые облегчают/проверяют их идентификацию (Fei и Hughes, 2001).
- Третий — уменьшение количества палочек при transducin α-subunit (gnat1-/), который блокирует фототрансдукцию палочки (Calvert и др., 2000).

- Иллюстрация 16. Ответы в виде вспышек фоторецепторов — колбочек мыши, подготовленных в виде различных генотипов a. Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм, М. колбочек — при вспышках с 510 нм — b. Сравнение средних ответов — вспышки колбочек на вспышки (сигнала) с 361 нм дикого типа S-колбочек, gnat1-/- Булочки, Nrl/-колбочки, и палочки, зарегистрированные под тем же самым "РТОМ" условии. Каждый след - ответ фоторецепторов измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) с разрешением из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, требуется фоновый свет, чтобы подавить ответ палочки так, чтобы ответ колбочки мог быть изолирован. В результате ответ колбочки был немного приспособлен светом, поэтому немного более быстр и меньший для данной интенсивности испытательной вспышки, чем это от gnat1-/- или Nrl-/-кобочек. Когда этот фактор учитывался, легкие свойства ответа колбочек мыши, зарегистрированных от трех mouselines, очень подобны и как ожидается это относится к колбочкам млекопитающих (иллюстрация 16, Стол 3) (Никонов и др., 2006). Видно, ЧТО среди этих особенностей - то, что колбочки мыши намного более терпимы, чем палочки мыши к обесцвеченному пигменту. Темный поток восстанавливается существенно в обоих колбочках типа S-и M. после сильных вспышек (воздействующих на мембрану сигналов), которые отбеливают существенную фракцию фотопигмента. Однако, одно обнаруженное удивление состоит в том, что инактивация пигмента М. более задерживает ответ фоторецептора, чем пигмента S в отсутствии GRK1, предлагая существование GRK1-независимого механизма инактивации для пигмента S. Т.о. Nrl-/-колбочки отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/-колбочки выражают намного более высокий процент содержания фотопигмента S-opsin (синий цвет). Таким образом, трансгенные мыши, выражающие EGFP в их колбочках, и gnat1-/-мыши лучше, чем Nrl-/-мыши для того, чтобы изучать физиологию колбочек.

- Таблица 3. Динамика и параметры чувствительности палочек и кодбочек мыши 1.
Выводы[править | править код]
Согласно приведенным данных исследований Фототрансдукции в палочках и колбочках следует:
- В связи с большими достижения в понимании фототрансдукции палочки, с накопившимся большого количесва фундаментальных исследований начиная с введения электрода всасывания, позволяющего производить запись техники при экспериментах в конце 1970-ых (Baylor и др., 1979a), планируемых генных методов 2000-х годов. Фоторецепторы человека, земноводных и относящиеся к млекопитающим (включая примата), могут быть использованы для исследоаний этим методом. Бычья сетчатка была любимой при подготовке к тому, чтобы изучить фототрансдукцию биохимиками из-за изобилия доступной ткани, но мышь стала более популярной моделью животных для исследования, т .к. в прошлом десятилетии добавились более глубокие методы исследований как, например, планируемые методы генных технологий. См. Таблица 1, рис. 2,3.
- Так уже можно увидеть на иллюстрации 16 в сетчатках (в фокальной поверхности) позвоночных животных (мыши, быки) содержатся фоторецепторы палочки и колбочки.
а) — видны полученные кривые ответов колбочек S,M. (синих, зелёных) b) — видны полученные кривые ответов колбочек S,M.,L (синих, зелёных, красноватых) и палочек без цвета.
- В таблице 3 приведены параметры колбочек S,M.(синих, зелёных) и палочек, и характеристики источника фотонного пучка — луча излучателя, воздействующего на фоторецепторы сетчатки.
Откуда, восприятие света и цвета исследовалось на живых клетках, с применением флюоресцентной микроскопии на рецепторном уровне — в сетчатке глаза позвоночных животных. Главнейший механизм восприятия света как фототрансдукция с участием меняющихся фотопигментов возможно было исследовать даже с применением генных методов, вводя различные варианты генетических кодов строения клеток, например, мембраны при котором палочки/колбочки обучаются воспринимать свет по заданной программе. При этом однозначно доказано, что палочки воспринимают слабые лучи света (безцветные-серые), колбочки воспринимают спктральные цветы. При этом колбочки делятся на колбочки-S(синие), колбочки-M.(зелёные), колбочки-L(красные).
Также доказано и показано, что появилась возможность уже не гипотетически (как, например, на базе нелинейной теории зрения С.Ременко заниматься исследованиями клеток зрительной системы на основе заменителей самих живых клеток - заменяя глаз, сетчатку, колбочки и палочки фототранзисторами, светофильтрами, колориметрами ). Сейчас учёные биофизики, биохимики в содружестве с физиками, учёными и представителями точного оптико- механического производства в своих исследованиях на живых клетках уже на генетическом уровне далеко ушли вперёд. Все новейшие достижения последних десятилетий учёных разных континентов подтверждают и развивают ранее полученные данные, начиная с использовании различных анатомических методов, среди которых - определенная нервная окраска, названная в честь известного раннего итальянского neuroanatomist, Камило Голджи (1885), кто жил в конце прошлого столетия. (Этот красящий метод использовался наиболее экстенсивно и с экстраординарным успехом большим испанским анатомом Рамоном y Cajal (1892). Данный метод и сейчас актуальный. Например, флюоресцентная наноскопия).
Общепризнанный принцип (трихроматизма) — основа трёхкомпонентной теории цветного зрения принята во всём мире!
Следует заметить, что принцип нелинейной теории зрения Р.Ременко (что в восприятии света и цвета участвуют только блок палочка+колбочка) не подтверждается последними приведенным данными отчётов исследований ведущих институтов и лабораторий, отчётов отдельных видных учёных в области зрительной системы. Поэтому, к сожалению, труды советского учёного С.Ременко не находят широкого признания в настоящее время в мире.
См. также[править | править код]
- Трёхкомпонентная теория цветного зрения
- Механизмы зрительных процессов с участием опсинов
- Ретиномоторная реакция фоторецепторов
- Биохимия зрительного восприятия
Примечания[править | править код]
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://humbio.ru/humbio/ssb/001181d1.htm
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks