Биохимия зрительного восприятия
- См. также Биохимия зрительного восприятия света
Биохимия зрительного восприятия (Визуальная фототрансдукция) — зрительный процесс, в котором свет преобразуется в электрохимические сигналы, в клетках палочек, колбочек и фоторецепторах ipRGC сетчатки глаза.[1]
Фототрансдукция в фоторецепторах сетчатки глаза палочках, колбочках и ipRGC — основа формирования оптического изображения в процессе зрения позвоночных животных, при участии сетчатки глаза.[2]
Введение[править | править код]
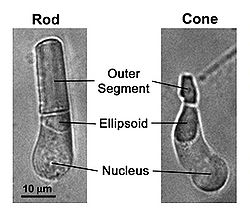
Формирование оптического изображение в процессе зрения у позвоночных животных связано с находящимися к сетчатке глаза колбочек (cone) и палочек (rod) и в то же время при зрении участвуют фотосенсоры ipRGC, расположенные в сетчатке вне фокальной поверхности, но непосредственно не формируют оптическое изображение, а участвуют в работе колбочек и палочек. Палочки специализированы для «низко-легкого» зрения. Они чрезвычайно чувствительны и могут сигнализировать поглощение одиночных фотонов. Колбочки обеспечивают видения дневного света (иллюстрация 1). Они намного менее чувствительны свету, чем палочки, но обладают более длительнным временным восприятием. Они также обеспечивают цветное зрение благодаря наличию нескольких типов колбочек с изменчивыми фотопигментами, чувствительных к различным спектральным лучам.
- Рис. 1. Светлопольные изображения фоторецептора палочки и фоторецепторов колбочки, изолированных от сетчатки саламандры. Фототрансдукция имеет место во внешней доле, в то время как эллипсоид плотно упакован mitochondria. Палочки ответственны за тусклое легкое видение, колбочки для видения яркого света.
Имеются большие достижения в понимании фототрансдукции палочки. Начиная с введения электрода всасывания, позволяющего производить запись техники при экспериментах в конце 1970-ых (Baylor и др., 1979a). Фоторецепторы человека, земноводных и относящиеся к млекопитающим (включая примата), могут быть использованы для исследоаний этим методом. Бычья сетчатка, с другой стороны, была любимой при подготовке к тому, чтобы изучить фототрансдукцию биохимиками из-за изобилия доступной ткани. Мышь, однако, стала более популярной моделью животных для исследования в прошлом десятилетии при помощи появившихся планируемых генных методов. Когда это объединено с электрофизиологией, генетика мыши обеспечивает непревзойденную власть в объяснении в естественных условиях функции ключевых белков фототрансдукции, большинство которых было выбито, сверхвыражено или видоизменено в колбочках, приводя к богатому объему информации на принципах, лежащих в основе увеличения, восстановления и адаптации фотоответов палочка/колбочка (Таблица 1, рис. 2,3).

Таблица 1. Список главных белков, вовлеченных в палочке мыши и фототрансдукции колбочки, которые были выбиты, сверхвыражены или mutated1 1) из-за высокого ограничения, но не все генетически проектируемые линии мыши перечислены. Для включенных только перечислены самые существенные фенотипы (в тексте дано более полное описание). 2) Arrestin4 также называют колбочкой-arrestin или X-arrestin (Gurevich и Gurevich, 2006; Никонов и др., 2008) 3) сверхвыражение RGS9-1 было достигнуто сверхвыражением R9AP, который привел к сверхвыражению всех трех компонентов комплекса ПРОМЕЖУТКА, RGS9-1, G_5-L и R9AP.
В описании сначала даны структуры и развитие фоторецепторов мыши, сопровождаемых резюме недавних исследований фототрансдукции палочки с акцентом на информацию, подбираемой от образцов мыши. В конце — упомянут недавний прогресс в обучающихся колбочках мыши.[5]
Зрительный цикл[править | править код]
Зрительный цикл - биологическое преобразование фотона в электрический сигнал в сетчатке. Этот процесс происходит через «G-протеины» en:G-protein_coupled_receptor, названные опсином, которые содержат хромофор en:11-cis_retinal цис-ретиналь, ковалентно связанный с опсиновым рецептором через основу Schiff — формирование retinylidene белка. Под действием фотона, цис-ретиналь en:11-cis_retinal подвергается фотоизомеризации en:Photoisomerization в «относящимся к сетчатке глаза всех-сделкок»en:All-trans_retinal, которая изменяет строение опсина GPCR en:GPCR, что приводит к началу каскадов переноса ( трансдукции) en:Signal_transduction, которые вызывают закрытие циклического канала катиона «GATED» и гиперполяризацию клетки фоторецептора.
Следующая изомеризация и выпуск от opsin белка, «относящаяся к сетчатке глаза вся-сделка»en:All-trans_retinal уменьшена до ретинолаen:Retinol «всей-сделки» и сигнал рефлекторно отправляется назад к относящемуся к сетчатке глаза эпителию пигмента en:Retinal_pigment_epithelium, который «перезаряжается». Это - первый esterified en:Ester ретинолом лецитина acyltransferase (LRAT) en:LRAT и затем преобразованный к ретинолу en:Rhodopsin с 11 СНГ isomerohydrolase RPE65 en:RPE65. Isomerase процессы RPE65 показали, но все еще неуверено, что действует ли это также как гидролаза. Но это окислено в «11 СНГ», относящееся к сетчатке глаза en:11-cis_retinal перед путешествием назад к внешней доле палочке, где это может снова восстановить (opsin) опсин для формирования нового, функционального визуального пигмента (rhodopsin) родопсин.
Фоторецепторы[править | править код]
Процесс фототрансдукции - сложный, и чтобы понять его, нужно иметь представление о структуре ячеек фоторецептора, вовлеченных в зрительный процесс: о палочках и колбочках. Эти ячейки содержат хромофор, (11-cis-retinal, альдегид Витамина A1 en:Vitamin_a) обязанный белку клеточной мембраны опсину. Палочки имеют дело с слабым освещением (низким легким уровнем) и не добиваются цветного видения. Конусы, с другой стороны, могут закодировать цвет изображения через сравнение продукций трех различных типов конусов. Каждый тип колбочки лучше всего отвечает на определенные длины волны, или цвета, света, потому что каждый тип имеет немного различный опсин (opsin). Три типа колбочек - L-конусы, М - колбочки и Булочки оптимально отвечают на длинные длины волны (красноватый цвет), средние длины волны (зеленоватый цвет), и короткие длины волны (синеватый цвет) соответственно.
Процесс[править | править код]
Чтобы понимать поведение фоторецептора в определении (intensities) интенсивности его работы, необходимо понять роли различных потоков.
Есть продолжающийся поток калия, направленный наружу через nongated K+ — отборные каналы. Этот поток направлен наружу и имеет тенденцию гиперполяризовать фоторецептор в пределах - 70 милливольтов (потенциал равновесия для K+).
Есть также внутренний поток натрия, который несут cGMP-gated каналы натрия. Этот так называемый темный поток деполяризует ячейку приблизительно до 40 милливольт. Отметьте, что это значительно более деполяризовано, чем большинство других нейронов.
Высокая плотность «Na+ - K+» насосов позволяют фоторецептору поддержать устойчивую внутриклеточную концентрацию Na+ и K+.
В темноте[править | править код]
Ячейки фоторецептора — не обычные ячейки, потому что они деполяризованы в темноте, то есть свет гиперполяризует и выключает эти ячейки и это роль света — как выключающий выключающиея ячейки, и который активизирует следующую ячейку - полученный возбужлённый сигнал посылается вниз нервной тропы.
В темноте, cGMP уровни высоки и держат cGMP-gated каналы натрия открытым с позволением устойчивого внутреннего потока, названного темным потоком. Этот темный поток держит ячейку деполяризованной приблизительно в 40 милливольтах.
Деполяризация мембраны ячейки открывает каналы кальция напряжения-gated. Увеличенная внутриклеточная концентрация Приблизительно при концентрации Ca2+ пузырьки en:Synaptic_vesicle являются причиной того, что содержащие специальные химикалии, названные медиаторами en:Neurotransmitters служат, чтобы слиться с мембраной ячейки. Поэтому выпуская медиатор в синаптическую расселину en:Synaptic_cleft, область между концом одной ячейки и начала другого нейрона en:Neuron. Освобожденный медиатор — глутамат en:Glutamate, медиатор, рецепторы которого бывают часто возбуждёнными.
В глутамате тропы конуса выполняют:
- Гиперполяризуют на-центре биполярные ячейки en:Bipolar_cells. Глутамат, который выпущен от фоторецепторов в темноте, связывает с metabotropic глутаматными рецепторами (mGluR6) en:Metabotropic_glutamate_receptor_6, который, через механизм сцепления «Белка г », заставляет неопределенные каналы катиона в ячейках закрываться, таким образом гиперполяризуя биполярную ячейку.
- Деполяризует биполярные ячейки вне центра. Закрепление глутамата на ionotropic глутаматные рецепторы приводит к внутреннему потоку катиона, который деполяризует биполярную ячейку.
На свету[править | править код]

*1) Легкий фотон взаимодействует с относящимся к сетчатке глаза в фоторецепторе. Относящееся к сетчатке глаза подвергается isomerisation, изменяющемуся от 11 СНГ до конфигурации все-сделки.
- 2) Относящийся к сетчатке глаза больше не вписывается в opsin обязательный участок.
- 3) Opsin поэтому подвергается конформационному изменению к metarhodopsin II.
- 4) Метарходопсин II непостоянен и расколы, уступая opsin и относящаяся к сетчатке глаза все-сделка.
- 5) opsin активизирует регулирующий белок transducin. Это заставляет transducin отделять от его связанного валового внутреннего продукта, и связывать GTP, тогда алфавитная подединица transducin отделяет от беты и гамма подединиц, с GTP, все еще обязанным к алфавитной подединице.
- 6) Алфавитный комплекс подединицы-GTP активизирует phosphodiesterase.
- 7) Phosphodiesterase ломает cGMP к 5 '-GMP. Это понижает концентрацию cGMP и поэтому каналы натрия близко.
- 8) Закрытие каналов натрия вызывает гиперполяризацию ячейки из-за продолжающегося потока калия.
- 9) Гиперполяризация ячейки заставляет каналы кальция напряжения-gated закрываться.
- 10) Как уровень кальция в снижениях ячейки фоторецептора, также понижается количество глутамата медиатора, который выпущен ячейкой. Это - то, потому что кальций требуется для содержания глутаматом пузырьков, чтобы соединиться с мембраной ячейки и выпустить их содержание.
- 11) Уменьшение в количестве глутамата, выпущенного фоторецепторами вызывает деполяризацию На биполярных ячейках центра (палочка и колбочка «На биполярных ячейках»), и гиперполяризация огораживают биполярные ячейки дорожными конусами.
Дезактивация каскада фототрансдукции[править | править код]
GTPase (Activating Protein (GAP)) — формирование «Белка (ПРОМЕЖУТОК)» взаимодействует с алфавитной подъединицей transducin, и заставляет это гидролизировать его связанный GTP к общему внутреннему содержанию, и таким образом останавливает действие phosphodiesterase, останавливая преобразование cGMP к «В».
Циклаза Guanylate, активизирующая белок (GCAP), где кальций обязательный белок, и поскольку уровни кальция в ячейке уменьшились, GCAP отделяет от его связанных ионов кальция, и взаимодействует с гуанилат-циклазой, активизируя это. Гуанилат-циклаза тогда продолжает преобразовывать GTP к состоянию cGMP, пополняя cGMP уровни ячейки и таким образом повторно открывает каналы натрия, которые были закрыты в течение фототрансдукции.
Наконец, Метарходопсин II дезактивирован. Recoverin, другой кальций обязательный белок, является обычно обязанным к Киназе Rhodopsin, когда кальций присутствует. Когда идёт падение уровней кальция в течение фототрансдукции, кальций отделяется от recoverin, и rhodopsin киназа выпускается при переходе к фосфорилату metarhodopsin II, уменьшая его близость к transducin. Наконец, arrestin, другой белок, связывает phosphorylated metarhodopsin II, полностью дезактивируя это. Таким образом, наконец, фототрансдукция дезактивирована, и темный текущий и глутаматный выпуск восстановлен. Это - тропа, где Метарходопсин II - phosphorylated и обязанный к arrestin таким образом дезактивировать, который, как думают, является ответственным за компонент S2 адаптации к темноте. Компонент S2 представляет линейную секцию подарка функции адаптации к темноте в начале адаптации к темноте для всего отбеливания intensities.
Относящаяся к сетчатке глаза «все-сделки» транспортируется к пигменту эпителиальные ячейки, которые будут уменьшены до ретинола все-сделки, «предшественник к относящимся к сетчатке глаза 11 СНГ». Это тогда транспортируется назад к палочкам. Ретинол все-сделки не может синтезироваться людьми и должен поставляться витамином А в диете. Дефицит ретинола все-сделки может привести к вечерней слепоте. Это - часть отбеливания и перерабатка en:Bleach_and_recycle процесса retinoids в фоторецепторах и относящемуся к сетчатке глаза эпителий пигмента.
Модель фототрансдукции колбочки мыши[править | править код]
Недавно были достигуты существенные успехи в понимании трансдукции колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Однако, несмотря на огромный успех в изучении фототрансдукции палочки за счёт комбинации генетики мыши и электрода всасывания, делающего запись в исследованиях последних лет при использование мыши, т.к. образцовая система для того, чтобы изучать фототрансдукцию колбочки была до недавнего времени ограничена исследованиями ЭРГА. Это из-за того, что процент колбочек в сетчатке мал (~3 %) и недолговечность внешней доли (мембраны) (САЛАТ РОМЭН).
Это препятствие было наконец преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и не допускают более хрупким САЛАТОМ РОМЭН хорошо вовлекать ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ»), фоторецептора колбочки, относящейся к сетчатке глаза пластине, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981) как ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый вид испытывает недостаток в нервном лейциновом факторе транскрипции застежки - молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу ячейки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй EGFP экспрессов в кодбочках мыши, который облегчает/проверяет их идентификацию (Fei и Hughes, 2001).
- Третий испытывает недостаток в палочке transducin α-subunit (gnat1-/-), который блокирует фототрансдукцию прута (Calvert и др., 2000).
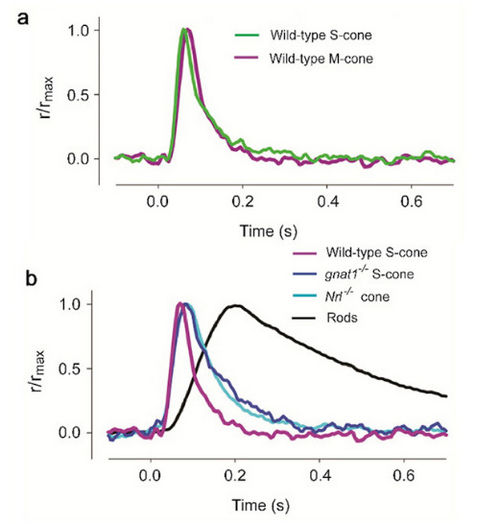
- Иллюстрация 16. Ответы вспышки фоторецепторов конуса мыши от различных генотипов. a. Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм и М. конусов при вспышках с 510 нм b. Сравнение средних ответов вспышки на вспышки с 361 нм дикого типа S-cones, gnat1-/- Булочки, Nrl-/- колбочки, и палочки, зарегистрированные под тем же самым "РТОМ" условии. Каждый след измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) с разрешением из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, фоновый свет требуется, чтобы подавить ответ прута так, чтобы ответ конуса мог быть изолирован. В результате ответ конуса немного приспособлен светом, поэтому немного более быстр и меньший для данной интенсивности испытательной вспышки чем это от gnat1-/- или Nrl-/- конусы. Когда этот фактор учтен, легкие свойства ответа конусов мыши, зарегистрированных от трех mouselines очень подобны и как ожидаются от относящихся к млекопитающим конусов (иллюстрация 16, Стол 3) (Никонов и др., 2006). Видный среди этих особенностей - то, что конусы мыши намного более терпимы чем пруты мыши к обесцвеченному пигменту. Темный поток оправляется существенно в обоих конусах типа S-и M после сильных вспышек, которые отбеливают существенную фракцию пигмента. Одно обнаружение удивления, однако, состоит в том, что инактивация М. пигмента более задержана чем тот из пигмента S в отсутствии GRK1, предлагая существование GRK1-независимого механизма инактивации для пигмента S. Nrl-/- конусы отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/- конусы выражают намного более высокий процент от S-opsin. Таким образом, трансгенные мыши, выражающие EGFP в их конусах и gnat1-/- мыши лучше чем Nrl-/- мыши для того, чтобы изучать физиологию конуса.
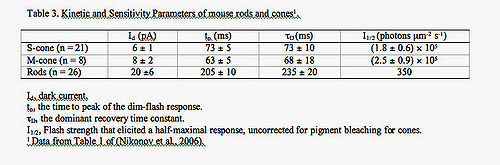
- Таблица 3. Динамика и параметры чувствительности палочек и кодбочек мыши 1.
См. также[править | править код]
Примечания[править | править код]
- ↑ http://en.wikipedia.org/w/index.php?title=Visual_phototransduction&action=edit§ion=7
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
Литература[править | править код]
- Moiseyev G, Chen Y, Takahashi Y, Wu BX, Ma JX. RPE65 is the isomerohydrolase in the retinoid visual cycle. Proc. Nat. Acad. Sci. 2005 Article. [1]
- Jin M, Li S, Moghrabi WN, Sun H, Travis GH. Rpe65 is the retinoid isomerase in bovine retinal pigment epithelium. Cell. 2005 Article.[2]
Внешние связи[править | править код]
- Visual pigments and visual transduction at med.utah.edu [3]
- A General Overview on Visual Perception at brynmawr.edu [4]
- MeSH Phototransduction [5]
- перенаправление шаблон:цвета радуги
| [показать]Цвета и оттенки | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 |
|  | |||||||||||||||||||||||||||||||||||
| ∘ ∘ ∘ | |||||||||||||||||||||||||||||||||||||