Амакриновые клетки сетчатки глаза
| Амакриновые клетки сетчатки глаза
(Свет снизу) | |
|---|---|
 Рис. Р.[1]
Стрелка и пунткирна линия — внешняя пограничная мембрана | |
Амакриновые клетки сетчатки глаза (A) (от греч. а — отрицательная частица, makrós — длинный, is, род. п. inós — волокно) — наиболее разнообразный тип нейронов сетчатки глаза, крупные, округлые клетки, не имеющие аксонов. Это слой ассоциативных нейронов сетчатки глаза, которые получают входные сигналы от биполярных нейронов Bi и других амакриновых клеток и посылают сигналы ганглиозным клеткам — G — и другим биполярам.
Подобно горизонтальным клеткам наружного синаптического слоя сетчатки, амакринные клетки располагаются во внутреннем зернистом слое сетчатки глаза, в плоскости внутреннего синаптического слоя сетчатки. Они образуют чрезвычайно сложную, соединенную щелевыми контактами сеть, а отросток, не покидая пределов сетчатки, ветвится в области синаптических контактов биполярных ганглиозных нейронов, они изменяют характер распространения возбуждения сигналов по нервным клеткам ганглиозного слоя. Число этих клеток особенно велико у животных с высокой остротой зрения, например, у птиц[2].
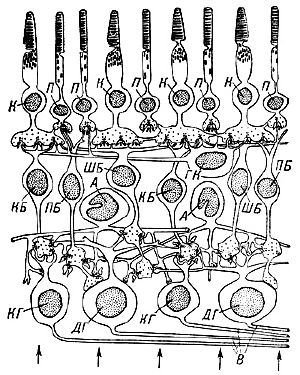
На рис.Р,3 показаны строение разных клеток сетчатки и связи между ними. Стрелки указывают, что свет попадает на сетчатку снизу[3][4][5].
На рис.3,Р показаны клетки и их расположение в слоях:
- П — палочки;(Наружные и внутренние сегменты фоторецепторов фокальной поверхности сетчатки)
- К — колбочки;(Наружные и внутренние сегменты фоторецепторов фокальной поверхности сетчатки)
- КБ — карликовые биполярные клетки
- ПБ — палочковые биполярные клетки
- ШБ — щётковидные биполярные клетки
- ГК — горизонтальные клетки
- A — амакриновые клетки сетчатки глаза
- КГ — карликовые ганглиозные клетки (слой ганглиозных фоторецепторов ipRGC и pRGC);
- ДГ — диффузные ганглиозные клетки (слой ганглиозных фоторецепторов ipRGC и pRGC);
- В — отростки ганглиозных клеток — нервные волокна, образующие зрительный нерв.
Введение[править | править код]
Амакриновые клетки характеризуются большим разнообразием типов, сложностью синаптических соединений. Так, у плотвы обыкновенной Rutilus rutilus различают 43 подтипа амакриновых клеток; в сетчатке приматов не менее 26 типов амакриновых клеток.
Клетки типа AII (А) (см. рис.Р) выполняют уникальную функцию среди амакринных клеток, в которых участвует преобладающая в вертикальном потоке информация, хотя внутренняя сетчатка вносит в это вклад: сосредотачивает механизмы не в боковых запрещающих тропах. Многослойная стратификация и синаптические партнёры показывают клетку AII (см. рис.Р), передачу ею управляющих сигналов палочкам и колбочкам в пределах "НА" - и "НЕ" сетчатки глаза в тропах только во внутренней сетчатке.
Эта глава суммирует морфологические и физиологические особенности клеток AII (A) (см. рис.Р) исходя из данных, полученных от четырех разновидностей млекопитающих: крыс, котов, кроликов, и обезьян[6].
Морфология и разновидности[править | править код]
AII (А) амакриновая клетка, первоначально описанная Kolb и Famiglietti (1974; Famiglietti и Kolb, 1975) — как наиболее изученной амакриновой клетки позвоночной сетчатки. Это было идентифицировано в разнообразии сетчаток млекопитающих. AII — узкая область bistratified амакриновой клетки, которая вовлечена в синаптические контакты всюду по IPL (см. рис.С). Её морфология была идентифицированапри помощи использования разнообразие методов окрашивания, типа методов Golgi (Рис. 1a) (Kolb и Famiglietti, 1974; Famiglietti и Kolb, 1975), Люцифер и маркировка HRP зарегистрированных нейронов (Нельсон, 1982), и флуоресцентные краски, типа DAPI (4,6-diamidi no-2-phenylindole) или Желтый Люцифер (Vaney, 1985, 1991; Заводы и Massey, 1991).
В настоящее время при флюоресцентной микроскопии живых клеток усовершенствованный метод Golgi получил широкое применение. При этом следует учесть, что при исследовании флюоресцирующих клеток, например, колбочек, палочек, метод Golgi отпадает, т.к. при воздействии спектральных лучей — синих, зелёных, красных и др. клетки колбочки, палочки в результате трансдукции вырабатывают сигналы с электромагнитными волнами с длинами волн синих, зелёных, красных лучей, которые улавливаются микроскопом. Остальные нужные клетки окрашиваются контрастирующими красителями, которые выделяются также. И всё это на молекулярном уровне.
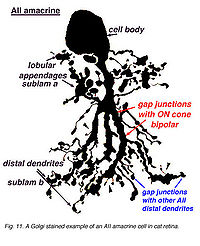
- Рис. 1a. Golgi запятнанное изображение AII amacrine клеток в сетчатке кота.
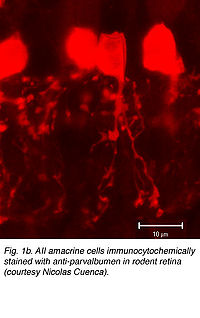
- Рис. 1b. AII амакриновые клетки immunocytochemically запятнанные с anti-parvalbumen растворяющей сетчатку (любезность Николас Куенка).
Позже immunocytochemical методы, планирующие использование различного кальция в обязательных белках (парвальбумин и calretinin) использовались, чтобы выборочно маркировать клетки AII в кролике (Казино и др., 1995; Massey и Заводы, 1999) и грызун (рис. 1b) (Wassle и др., 1993). Примат амакриновой клетки AII также помечен calretinin (Wassle и др., 1995; Заводы и Massey, 1999), хотя не выборочно (Kolb и др., 2002). Независимо от используемой техники, амакриновая клетка AII имеет последовательную морфологию (иллюстрация 1a) с круглой или овальной формой тела клетки, равной 8-10um (1um=0,1мкм) в диаметре, расположенной в ближайшем внутреннем ядерном слое. В периферийной сетчатке, тело клетки часто простирается в системе импульсного пространства IPL (см. рис.Р). Распределение тел клетки AII неслучайно. Оно формирует регулярную мозаику (Vaney, 1985; Заводы и Massey, 1991; Kolb и др., 2000). Расчётные индексы регулярности располагаются от 4.0 (низшая сетчатка) до 5.4 (временная midperipheral сетчатка) у кролика (Vaney и др., 1991a), кот (Vaney, 1985) и крысы (Wassle и др., 1993); более низкая ценность индекса была вычислена у обезьяны (Wassle и др., 1995). AII (см. рис.Р) древовидные деревья, как сообщают, более регулярно распределяются, чем их тела клетки, с их процессами, заполняющиеся в промежутках между смежными телами клетки, чтобы получить полный обзор IPL (Vaney и др., 1991a; Wassle и др., 1995).
Bistratified природа амакриновых клеток AII является результатом двух отличающихся древовидных деревьев (иллюстрации 1a, b). Древовидное дерево в подтонкой пластинке (s1 и s2) составлено из коротких, тонких процессов, заканчивающихся в lobular придатках, которые исходят во всех указаниях от типично единственного первичного дендрита (Famiglietti и Kolb, 1975; Kolb и Famiglietti, 1976; Vaney и др., 1991b; Strettoi и др., 1992). Количественный анализ последовательных секций одной специфической амакриновой клетки AII кролика (Strettoi и др., 1992) идентифицировала 21 lobular придаток, который расположен в диаметре от 1.6 - 5.5um (1um=0,1мкм). Напротив, процессы, которые формируют древовидное дерево в подтонкой пластинке b, называют отдалёнными от центра (или древесный) дендритами, заканчивающиеся преимущественно в страте 5. Отдалённые от центра дендриты - тонкие процессы, которые обладают спинными хребтами по их длине и ветвями более широкими, чем lobular придатки (иллюстрация 1a). Вышеупомянутые особенности сохранены у кролика, крысы, кота, и сетчатках обезьяны макаки (Kolb и др., 1976; Vaney, 1985; Kolb и др., 1992; Wassle и др., 1993; Wassle и др., 1995; Заводы и Massey, 1999).
Распределение амакриновых клеток AII и морфология отличны в центральной по сравнению с периферийной сетчаткой. Плотность AII является самой большой в extrafoveal центральной сетчатке и уменьшается с увеличивающейся оригинальностью. Одновременно, обе древовидные области увеличиваются по сравнению с оригинальными (рис. 2a) (Kolb и др., 1981; Заводы и Massey, 1991; Vaney и др., 1991a; Vaney и др., 1991b; Wassle и др., 1993), с более явным изменением отдалённых от центра дендритов. Например, плотность клетки AII в центральной сетчатке кота максимальна в 5300 клеток/
Синаптическая возможность соединения[править | править код]
Введение химиката в отдалённые дендриты[править | править код]

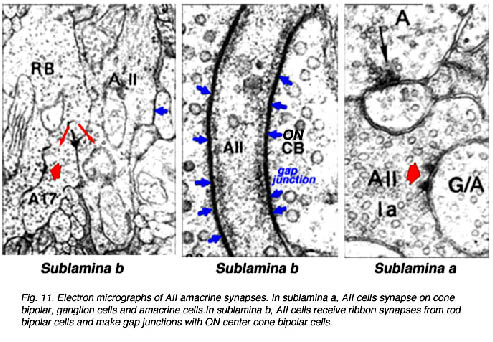
AII (см. рис.Р) получает прямые входы glutamatergic в подтонкой пластинке b (s5) от биполярных клеток палочек (РБК) (Рис. 3). В этом синапсе AII формирует один члена постсинаптической пары (Kolb и Famiglietti, 1974; Famiglietti и Kolb, 1975; Strettoi и др., 1990; Strettoi и др., 1992; Chun и др., 1993; Ким и др., 1998); другой член (обсужденный ниже) - GABA-содержание амакриновых клеток, известная как A17 у кота и S1/S2 у кролика (Massey и др., 1992). Последние типы клеток имеют взаимные синапсы, идущие назад на терминал РБК в рецепторах GABAc на РБК (Sandell и др., 1989; Grunert и Wassle, 1990; Strettoi и др., 1990; Chun и др., 1993; Ким etal., 1998; Zhang и др., 2002). Каждый AII получает вход от нескольких RBCs.
Во всех млекопитающих физиологические исследования показывают, что выявляемые глутаматом потоки в AII амакриновых клетках установлены с AMPA-предпочтением рецепторов, (Шиканье и др., 1993; Cohen и Мельник, 1999; Morkve и др., 2002) чувствительный к не отборному антагонисту CNQX и рецептором AMPA с определенными составами GYKI-52466 и циклотиазидом (Morkve и др., 2002; Певец и Алмаз, 2003; Veruki и др., 2003). Рецепторы сформированы из GluR3 (Dacheux и Raviola, 1986; Qin и Pourcho, 1999a, 1999b; Габриэль и др., 2002) и/или GluR4 (Ghosh и др., 2001; Литий и др., 2002) подединицы (рис. 4) обеспечивают высокую проходимость кальция в канале.
Ответы NMDA были также идентифицированы на крысе (Hartveit и Veruki, 1997) и кролике (Блумфилд и Xin, 2000) клетки AII. Эти полученные данные противоречат исследованиям immunocytochemical, которые отмечают отсутствие под-единиц рецептора NMDA на древовидных процессах AII (Hartveit и др., 1994; Goebel и др., 1998; Флечер и др., 2000; Grunert и др., 2002). Недавние полученные данные указывают, что ответы NMDA не добиваются передачи сигналов в синапсе RBC-to-AII (Певец и Алмаз, 2003), предлагая рассматривать эти рецепторы, как подарок, который может быть расположен экстра--synaptically. Ответ NMDA в клетках AII может также зависеть от внутриклеточной тропы передачи сигналов, поскольку зажим сокращает ответ в быстрых исследованиях на участках (Hartveit и Veruki, 1997).
Хотя одна AII амакриновая клетка связана почти со всеми палочками пар РБК, то биполярные связи включают только ~30% входов к клеткам AII (Strettoi и др., 1992). Эти клетки также получают химические входы от других амакриновых клеток в пределах s1 и s5 у кролика; s1, s3-s5 у крысы и у кота, также и у обезьяны. Амакриновая клетка (ки) предсинаптическая к отдалённым от центра дендритам AII вообще не идентифицировалась, за исключением допаминергических амакриновых клеток у кота (Kolb и др., 1990). Контакты Amacrine включают ~40% синаптических входов в подтонкой пластинке b согласно Strettoi и др., (1992).
Подключения к электросети отдалённых дендритов[править | править код]
AIIs электрически соединены с "НА" биполярных клеток колбочек (Си-би-си) всюду по подтонкой пластинке b (рис. 3) (Kolb и Famiglietti, 1974: Famiglietti и Kolb, 1975: Kolb, 1979; Strettoi и др., 1992; Veruki и Hartveit, 2002a) и к другим клеткам AII в s5 (Strettoi и др., 1990; Strettoi и др., 1992; Strettoi и др., 1994). Соединения AII/AII структурно сформированы из connexin 36 (Feigenspan и др., 2001; Заводы и др., 2001). Распространение сигнала двунаправлено, продвигая синхронизированные ответы (то есть, потенциалы действия) среди связанных клеток (Veruki и Hartveit, 2002b).
Присутствие допамина уменьшает сцепление AII/AII (Заводы и Massey, 1995) через активацию рецепторов допамина D1-типа (Hampson и др., 1992) и формирование лагеря (рис. 5a) (Hampson и др., 1992; Бондарь и др., 1996). Напротив, соединения промежутка, сформированные между AII и НА-СИ-БИ-СИ, являются несоответствующими, сформированными connexin 36 на процессах AII и или connexin 36, или другой (возможно 45) connexin на Си-би-си (Feigenspan и др., 2001; Заводы и др., 2001; Лин и др., 2005). Эти соединения также двунаправлены (Cohen и Мельник, 1999; Блумфилд и Xin, 2000; Trexler и др., 2001), хотя сигналы более эффективно размножены в руководстве, AII к НА-СИ-БИ-СИ (Veruki и Hartveit, 2002a). Проходимость каналов AII/ON-CBC, кажется, регулировалась азотной окисью и cGMP (Заводы и Massey, 1995). Азотная окись активизирует guanylate циклазу, увеличивая внутриклеточный cGMP, и уменьшает сцепление между этими типами клеток.


Степень связи среди клеток AII очень изменяется при моделировании оценок, что когда каждый AII подсоединён к трём другим клеткам AII (Vardi и Смит, 1996) с исследованиями сцепления краски, замечено, что сеть может расположиться из ~20 до 300 двойных клеток (Vaney, 1991; Блумфилд и др., 1997). Это различие в степени сцепления зависит от присутствия adaptational (рис. 5b). Изменения в сцеплении AII/AII показали изменения в диаметре восприимчивого полевого центра (иллюстрация 5b). Например, в адаптировавшейся к темноте ткани, когда одна клетка AII соединена с сетью ~20 других клеток, и соответствующий диаметр восприимчивого полевого центра составляет в среднем ~74 гм (Блумфилд и др., 1997). Когда интенсивность света увеличена, но все ещё в пределах операционного диапазона клетки (~2.25 единицы интенсивности регистрации), и способствовала увеличению степени сцепления и диаметра восприимчивого полевого центра (рис. 5b). Далее связано с увеличением небольшой световой интенсивности фактически приводят к уменьшению в сцеплении к уровням, сопоставимым с замеченными в адаптировавшихся к темноте условиях (Рис. 5b). Таким образом, клетки экстенсивно соединяются по их операционному диапазону, но не попарно на краях этого диапазона.
Какая выгода получается при изменении степени связи? Сцепление AII/AII является неотъемлемой частью в оптимизации отношения сигнала-к-шуму сети AII (Блумфилд и др., 1997; Блумфилд и Dacheux, 2001), поскольку это позволяет меньшим коррелированым сигналам палочки быть увеличенными, в то время как некоррелированый шум уменьшен (Смит и Vardi, 1995; Vardi и Смит, 1996). Это можно считать важным, когда сетчатка работает в тусклом свете intensities (mesopic условия), поскольку увеличенное сцепление максимизирует область, от которой каждый AII может слить пространственно коррелированные сигналы, и таким образом увеличивая сигнал к шумовому отношению. В адаптировавшихся к темноте условиях, однако, минускульное (маленькое) число фотонов периодически поглощено палочками, и число коррелированых сигналов — небольшое (Блумфилд и Dacheux, 2001). В зависимости от соединения клеток AII, можно им всем получить общие входы связей AII, усиление ответа при суммировании коррелированных сигналов и уменьшение шума (Смит и Vardi, 1995; Vardi и Смит, 1996). Однако, при условии, что число коррелированых сигналов, достигающих сети не у всех AII, и обширное сцепление на этих низких легких уровнях не имеет никакого преимущества, поскольку это увеличило бы фоновый шум, вызывая слабые сигналы, которые могут распространиться со стороны и привести к уменьшению полной амплитуды ответа. Сцепление также уменьшено в приспособлённых к свету условиях, уменьшая передачу, и потерю, сигналов колбочки через сеть AII (см. рис.Р), облегчающую высокую пространственную остроту в условиях оптического изображения (Блумфилд и Dacheux, 2001). Далее, высокие уровни сигнала-к-шуму в системе колбочек уменьшают потребность в пространственном усреднении.

Соединения промежутка между AII/ON-CBC обеспечивают механизм, через который сигналы палочки достигают НА-НЕРВНОМ-УЗЛЕ ячеек (Kolb, 1979) через кругооборот: палочка к палочке, биполярному AII к НА-КОЛБОЧКЕ к биполярной клетке, к клетке НА-НЕРВНОГО-УЗЛА (Рис. 6, красный круг, синий квадрат). Поскольку эти соединения промежутка также двунаправлены, они обеспечивают дополнительную тропу, через которую AIIs получают управляемые колбочкой входы (DeVries и Baylor, 1995; Cohen и Мельник, 1999; Xin и Блумфилд, 1999). Альтернативный маршрут закончил бы соединения промежутка палочка/колбочка, получая сигналы палочки фоторецепторами колбочек непосредственно (Нельсон, 1977). Сигналы палочки были бы переданы к биполярным клеткам колбочкам и затем прошли бы к AIIs в палочке кругооборот - колбочка – НА-КОЛБОЧКЕ биполярный-AII (DeVries и Baylor, 1995). Сигналы, происходящие в фоторецепторах колбочки, были бы переданы через эту дорожку также, и управляемые колбочкой ответы были зарегистрированы в ячейках AII (Нельсон, 1982; Xin и Блумфилд, 1999). Входы фотофильма от НА-СИ-БИ-СИ деполяризуют клетки AII, которые, в свою очередь, гиперполяризуют вне Си-би-си (рис. 6), подавляющий приспособленные светом ответы вне центра (Xin и Блумфилд, 1999). Как отмечено выше, соединения AII/ON-CBC, кажется, смодулированы НЕ, но не при свете, поскольку физиологические изменения сообщения об исследованиях в уровнях фонового света не изменяют наблюдаемую полную степень связи AII/ON-CBC (Bloomfieldm и др. 1997), и управляемые колбочкой ответы могут быть зарегистрированы от клеток AII в условиях фотофильма (Нельсон, 1882; Xin и Блумфилд, 1999).
Учитывая морфологическое разнообразие типов Си-би-си, полезно уточнить, какая определённая клетка (ки) соединена к AIIs, чтобы лучше понять основную схему. Заводы и Massey (1996) идентифицировали электрическое сцепление между AIIs и calbindin-положительной биполярной клеткой в кролике. Однако, поскольку только одна четверть биполярных клеток (23%), используя двойные трассирующие снаряды к AIIs calbindin-уверенна, то больше чем один тип НА-СИ-БИ-СИ вероятно делает соединения промежутка с AIIs (Massey и Заводы, 1996; Ким и др., 2004). В согласии с этим, недавнее исследование Veruki и Harveit (2002a) электрических свойств соединений промежутка AII/ON-CBC в крысе идентифицировало четыре типа биполярных клеток, а именно, CB5-CB8, электрически соединённый к AIIs в крысе (Euler и др., 1996). Кроме того последнее свидетельство от группы Масланда предлагает, чтобы часть из НА конусе bipolars соединённого с клетками AII выразила connexin 45, но не connexin 36 (Лин и др., 2005. В коте, cb5 биполярная клетка, как находили, была соединена с процессами AII (Нельсон и Kolb, 1983). cb5 биполярная клетка вероятно соответствует calbindin биполярной клетке в кролике, поскольку последний делает самое большое число соединений промежутка с ячейками AII (Strettoi и др., 1994).
Таким образом, электрическая связь в пределах сети AII функционирует, чтобы максимизировать передачу сигнала к постсинаптическим клеткам нервного узла. Поскольку AIIs получают и палочка - и управляемые колбочкой входы, калибр сигнала изменяет зависящую интенсивность стимула. Следовательно, динамика сети AII должна также изменяться непрерывно. Напротив, синаптическая передача через соединения промежутка AII/ON-CBC не затронута государством adaptational (Блумфилд и др., 1997), предлагая, что эта тропа может функционировать на длительном уровне, непрерывно передающем сигналы, независимые от легкого уровня светового луча к клеткам нервного узла.
Синапсы lobular придатков в подтонкой пластинке[править | править код]
Lobular придатки - главные химические синаптические участки системы AII амакриновых клеток (рис. 3) (Famiglietti и Kolb, 1975; Strettoi и др., 1992). Эта форма придатков взаимных, запрещающих синапсы в s1-s2 (Strettoi и др., 1992) с терминалами вне Си-би-си (Kolb и Нельсон, 1983; Strettoi и др., 1992; Chun и др., 1993; Merighi и др., 1996). Эти синапсы составляют 90% состава клеток AII у кролика (Strettoi и др., 1992). AII амакриновые клетки у кролика, у которых синапс расположен редко непосредственно на клетках вне нервного узла, тогда как у кота и синапсах обезьяны они расположены в ОТ клетках нервного узла обычно (Kolb, 1979). Запрещающие сигналы от AIIs передают в направлении к уменьшающемуся глутаматному выпуску вне Си-би-си к клеткам нервного узла не типично в течение лёгкого (слабого светового) возбуждения (рис. 6, синий круг).
Merighi и другие (1996) показали у кролика, что по крайней мере два различных типа вне Си-би-си (DAPI-Ba1 и DAPI-Ba2) являются постсинаптическими, идущими к клетке AII lobular придаткам в различных областях IPL. Терминал аксона клеток DAPI-Ba1 разветвляется в s2, в то время как клетки DAPI-Ba2 мультистратифицированны с boutons, расположенными в пределах s1-s3. У кота cb1 и cb2 биполярные клетки (Kolb и др., 1981), которые соответствуют DAPI-Ba2 и клеткам DAPI-Ba1, соответственно, клеткам контакта AII в подтонкой пластинке a. У приматов AII lobular придатки участвуют во взаимных соединениях (синапсах) с calbindin положительными терминалами аксона DB3 в s2 (Jacoby и Marshak, 2000). Другая биполярная клетка у макаки, DB2, является подобной образцу стратификации кролика DAPI-Ba2.
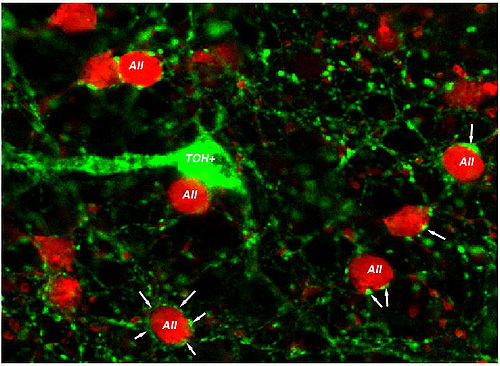
И дендриты AII и тело клетки являются постсинаптическими к другим amacrine клеткам в S1. Двойные исследования маркировки показали, что дендриты допаминергических амакриновых клеток окружают у сома AII, формируя характерные кольца как показано в иллюстрации 7 (Pourcho, 1982; Voigt и Wassle, 1987; Kolb и др., 1991). Эти допаминергические входы, как полагают, добиваются изменений в сцеплении AII/AII, которые происходят с государством adaptational. Однако, недавние полученные данные показывают, что прямые контакты между допаминергическими процессами и сома AII - GABAergic, а не допаминергический (так как допаминергические амакрины, как говорят, являются также уверенным GABA, Contini и Raviola, 2003). Таким образом, клетки AII могут получить прямые входы GABAergic в теле клетки, что могло также регулировать ответы света ячейки AII. Эти GABA-выявляемые ответы, от активации рецептора GABAA, привели бы к более быстрой модификации ответов AII по сравнению с действиями допамина, которые установлены через более медленные вторые каскады посыльного и можно посчитать paracrine природными. Это должно быть упомянуто здесь, что допаминергическая amacrine клетка, как теперь полагают, содержит глутамат (Jones и Марк, 2004) и если бы дело обстояло так, то ожидалось бы более быстрое действие передатчика также .
Физиологические ответы[править | править код]
Клетки самого AII - запрещающие glycinergic нейроны (Pourcho, 1996; Menger и др., 1998). Их самый сильный ответ, и уникальная роль, являются в период scotopic (сумеречно-ночное) уровней освещения. В этом случае AII помогает в увеличении и скорости передачи и амплитуде сигналов палочки, которые замечены как клетки нервного узла (Нельсон, 1982).
AII амакриновые клетки также называют «амакриновой клеткой палочки», потому что они имеют особенности ответа, типа порога уровня насыщенности и спектральной чувствительности, подобной палочкам (Нельсон, 1982; Блумфилд и Dacheux, 2001). Эти клетки показывают сложные физиологические ответы, которые служат и палочке и колбочке, относящиеся к сетчатке глаза тропы и они чувствительны к государству adaptational (рис. 8a). Вообще, AIIs производят TTX-чувствительные потенциалы действия и отвечают на exogenous заявление GABA, глицина, и глутамата (Шиканье и др., 1993). AIIs классифицированы как НА-ЦЕНТРЕ amacrine клетки, что при показе показе они окружены центром антагонизма (Нельсон, 1982; Dacheux и Raviola, 1986; Xin и Блумфилд, 1999), когда адаптировавшийся к темноте; они окружены антагонизмом, при отмене работы в приспособленных светом клетках (Xin и Блумфилд, 1999).
Поколение НА-ЦЕНТРЕ ответа[править | править код]
Основанный на синаптических связях AII, НА-ЦЕНТРЕ ответы их могли быть произведены через две тропы:
- (1) предписывают, чтобы управляемые палочкой входы от (НА-ТИПЕ) РБК были в химических синапсах, (или)
- (2) направили управляемые колбочкой входы от (НА-ТИПЕ) Си-би-си через электрические синапсы.
Физиологическая регистрация, показывая палочку - и управляемые колбочкой ответы в ячейках AII и фармакологические исследования указывают, что НА-ЦЕНТРЕ ответы блокированы заявлением APB (2-амино-4-phosphonobutyric кислота), указывая на то, что они произведены НА-ТИПЕ биполярными клетками (Xin и Блумфилд, 1999).


Как произведен НА-ЦЕНТРЕ ответ? Интересно, сигналы, переданные в пределах обеих из вышеупомянутых троп могут произвести ответ центра, со вкладами каждого изменения тропы в зависимости от интенсивности стимула (иллюстрация 8b). В адаптировавшихся к темноте условиях, ответы центра получены из управляемых палочкой или управляемых колбочкой входов, переданных непосредственно к AIIs от палочки BCs или от колбочки BCs через соединения промежутка. Заявление Exogenous или 8-bromo-cGMP или ХВАТКИ, которые не соединяют соединения промежутка AII/ON-CBC, не блокирует scotopic НА-ЦЕНТРЕ ответы, но действительно блокирует компонент сигнала колбочки. Яркие стимулы насыщают палочки уменьшающими управляемые палочкой входы до AIIs. В этих условиях блокированы НА-ЦЕНТРЕ ответы, когда соединения AII/ON-CBC являются фармакологически не двойными (Xin и Блумфилд, 1999). Таким образом, НА-ЦЕНТРЕ ответы в ячейках AII прибывают или от палочек или от колбочек. Сигналы палочки деполяризуют AIIs в адаптировавшихся к темноте (scotopic) условиях; управляемые колбочкой сигналы передаются в свете сигналов оптического изображения (фотофильм) на условиях сенсорной работы на первом уровне (не в цвете) (иллюстрация 8a и b). Интересно, временный ответ вне центра был также идентифицирован в приспособленных светом клетках AII. Этот ответ блокирован CNQX и как полагают, произведен через прямые входы glutamatergic от биполярных клеток вне колбочки на AII lobular придатки в подтонкой пластинке (Xin и Блумфилд, 1999).

Ответ света AII является двухфазным, с начальной переходной деполяризацией, сопровождаемой более длительным компонентом (иллюстрация 9). Это позволяет AII быстрее отвечать на лёгкий стимул (слабое освещение), чем это делает предсинаптическая биполярная клетка палочки и достигать его максимальной амплитуды более быстро. Фактически, в пике ответа AII, биполярный ответ палочки - одна треть его максимальной амплитуды (см. иллюстрацию 9). Клетка AII также повторно поляризуется по более быстрой норме (Нельсон, 1982). Переходная природа ответа света AII неожиданна, поскольку и предсинаптический РБК (Dacheux и Raviola, 1986) и фоторецепторы палочки производят медленные, длительные ответы. Это заставляет прийти к заключению, что изменение от длительного до переходного сигнала происходит в AII и служит, чтобы ускорить сигналы палочки, переданные к внутренней сетчатке (Нельсон, 1982). Какой основной механизма составляет производить изменения в ответе kinetics? На этот вопрос отвечено в недавней бумаге Певцом и Алмазом (2003). Они исследовали синапс RBC/AII, используя двойные методы зажима участка пластины в крысе, находящегося в сетчатке глаза. Переходный компонент ответа AII не происходил из-за запрещения обратной связи на РБК или к постсинаптической десенсибилизации рецептора AMPA, потому что это присутствовало, когда был применён или picrotoxin или cyclothiazide. Однако, форма волны EPSC действительно изменялась с притоком кальция в предсинаптический терминал, так как активация каналов кальция ограничивает норму exocytosis. Авторы заключают, что начальный переходный компонент ответа света AII происходит из-за быстрой нормы выпуска медиатора от терминалов РБК, соединенных с быстрыми kinetics постсинаптическими рецепторами AMPA (Певец и Алмаз, 2003).
Поколение НЕ-окружённого ответа[править | править код]
В начальной физиологической характеристике AIIs с "окружите ответы" были только идентифицированы в некоторых клетках (Нельсон, 1982). Впоследствии, показано, что антагонистические клетки окружают, присутствует только тогда, когда клетки являются адаптировавшимися к темноте (Xin и Блумфилд, 1999; Блумфилд и Xin, 2000). Разумная гипотеза данной морфологии AII, была бы той, что окружение произведено через связи между клетками AII и вне Си-би-си, поскольку этот синапс функционировал бы в адаптировавшихся к темноте условиях. Hoever, окружённый ответ блокирован CNQX (совместимый с ролью для вне Си-би-си), и также блокирован APB, предлагая, что окружение порождает в палочке биполярный синапс(ы) в IPL (подтонкая пластинка b), хотя сам РБК не показывает, сосредотачиваются/окружают ли такую обстановку (Xin и Блумфилд, 1999; Блумфилд и Xin, 2000).
Были предложены две тропы, чтобы составлять схему, лежащую в основе не окружённого ответа (рис. 10)). Сначала другая амакриновая клетка может через синапс непосредственно обеспечивать запрещающие входы к отдалённым от центра дендритам AII, как предложено анатомическими исследованиями. Во вторых, запрещающие синапсы обратной связи через терминалы РБК от A17 амакриновых клеток могут произвести, окружить ответы (то есть, (Блумфилд и Xin, 2000; Volgyi и др., 2002). Недавнее свидетельство одобряет эту последнюю тропу, которая получена в итоге ниже (иллюстрации 10).

A17 амакриновая клетка у кота, крысы, и обезьяны эквивалентна S1/S2, indolamine-накапливающейся амакриновой клетке у кролика (Sandell и др., 1989). Эта клетка, как AII, является управляемой палочкой (Нельсон и Kolb, 1985), и передача сигнала от РБК до клеток A17 в крысе блокирована CNQX (Hartveit, 1999). Однако, в других разновидностях immunocytochemical исследованииях идентифицировали metabotropic глутаматные рецепторы (Cai и Pourcho, 1999) и подединицы рецептора GluR1/2 (Ghosh и др., 2001; Литий и др., 2002) на дендритах A17. Эти полученные данные позволяют установить, что поток информации поперек пары РБК может быть установлен несколькими различными glutamatergic механизмами (Ghosh и др., 2001; Литий и др., 2002). Клетки Кота А17 показывают длительный лёгкий ответ и не получают антагонистическое окружение (Нельсон и Kolb, 1985); тогда как, окружающий центр антагонизм был сообщён для ячейки A17 крысы (Menger и Wassle, 2000).
A17 и S1/S2 амакриновые клетки устанавливают взаимные контакты в терминалах РБК. Ячейки A17 содержат GABA (Porcho и Goebel, 1983; Grunert и Wassle, 1990; Massey и др., 1992; Ким и др., 1998) и РБК запрещения через активацию рецепторов GABAc (Zhang и др., 2002; Донг и Заяц, 2003). Эта обратная связь GABAergic смодулирована лёгкой интенсивностью освещённости и активация рецепторов GABAA (Донг и Заяц, 2003) также представлены на палочке как биполярные терминалы (Euler и Wassle, 1998; Флечер и Wassle, 1999; McGillem и др., 2000; Volgyi и др., 2002), и замечена активация предсинаптических mGluR1/5 рецепторов (Euler и Wassle, 1998). Физиологически, эта палочка с изменениями обратной связи биполярных ответов, делая scotopic b-волну больше в виде переходного процесса (Донг и Заяц, 2003), и может быть вовлечена в изменяющиеся потоки кальция в терминалах РБК (Кастрюля, 2001); в конечном счете изменяя глутаматный выпуск, имеем вносящий свой вклад в окруженный механизм и в клетки нервного узла (Щиты и в Lukasiewicz, 2003) и AII amacrine ячейки (Volgyi и др., 2002).
У кота, клетка A17 — всегда другой член постсинаптической пары с AII амакриновых суть отдалённых от центра процессов, хотя другие амакриновые типы клетки также получают входы от биполярных клеток палочки (Kolb и Нельсон, 1983). Напротив, у кролика, или S1 или S2, indolamine-накапливающий амакриновые клетки, могли объединиться с AII. Почему этот синапс более сложен у кролика? Ответ может быть найден в различиях в морфологии и степени сцепления между этими двумя типами клеток. Ячейки S1 - широкая область amacrine клетки, которые показывают обширное сцепление с другими клетками S1 (то есть, до ~130 соединённых клеток), в то время как клетки S2 являются меньшими и не как экстенсивно соединёнными (максимум 35 соединённых клеток) (Литий и др., 2002). Эти различия дают возможность обеспечить клеткам S1 широко-полевой компонент с AII и окружить ответ, в то время как клетки S2 обеспечивают входы от более местного кругооборота (Литий и др., 2002; Zhang и др., 2002).
Роль в двойном видении[править | править код]
AII амакриновые клетки - место, где палочка и тропы колбочки, так же как НА - и перекрёсток вне троп. Это является центральным в scotopic (ночь) видении. Сложная физиология клеток AII сравнена с их разбросанной морфологией: их процессы расположены всюду по IPL, и синапсы были соблюдены в пределах всех "страт" (то есть, химические синапсы в s1, s2, и s5; электрические синапсы в s3, s4, и s5). Из-за этих связей, и параллельных, относящихся к сетчатке глаза троп, AII амакриновые клетки всегда получают входы, предоставляя внутренней сетчатке длительную запрещающую тропу (Cohen и Мельник, 1999).
В пределах тропы палочки (или scotopic (ночного) уровни света), стимулируемое уменьшение света в выпуске глутамата фоторецептора палочки деполяризует биполярные клетки палочки, в свою очередь вызывая выпуск глутамата от палочки биполярные терминалы на постсинаптические элементы пары: indolamine-накопление или A17 амакриновая клетка и AII амакриновые клетка. Глутамат взволновал AII, приводя к трем одновременным синаптическим событиям:
- (1) выпуск глицина на вне Си-би-си, в конечном счёте запрещающих клеток вне нервного узла,
- (2) деполяризация НА-СИ-БИ-СИ (через соединения промежутка AII/ON-CBC) и последующую деполяризацию НА-НЕРВНОМ-УЗЛЕ клеток,
- (3) увеличения сигнала к шумовому отношению из-за распространения сигнала среди двойной сети AII. Кроме того синапс клеток AII кота, обезьяны и крысы непосредственно идет на клетки вне нервного узла, приводя к прямому glycinergic запрещению этих клеток (то есть Muller и др. 1988). Ответы AII изменены запрещающими входами от деполяризованного A17 (S1/S2), клетки который работают с обратной связью с палочками биполярных терминалов. Полный эффект - запрещение вне тропы и возбуждения в НА-ТРОПЕ обеих управляемыми палочкой сигналами.
В условиях яркого света (фотофильм — цветное изображение) НА - и ответы вне центра были зарегистрированы от клеток AII (Xin и Блумфилд, 1999). Оба ответа произведены через входы от Си-би-си, с переходным ответом вне центра, являющимся результатом glutamatergic входы вне Си-би-си и НА-ОТВЕТЕ возникающая передача через соединения промежутка ON-CBC/AII. В то время как и НА - и вне ответов может быть найден преобладающий ответ в той же самой клетке AII, НА-ЦЕНТРЕ. Эти входы от НА-СИ-БИ-СИ деполяризуют клетки AII, вызывая glycinergic запрещение клеток вне нервного узла и вне Си-би-си (Muller и др., 1988). Кроме того, при условиях яркого света, сцепление в пределах сети AII уменьшено, предотвращая разложение сигналов колбочек до достижения клеток нервного узла. Полный результат, снова, состоит в том, что вне тропы запрещён НА-ТРОПЕ, в то время как высокие сигналы остроты колбочек (яркого изображения) поддержаны. Таким образом AII смешивает не только палочки и сигналы колбочки, но и НА - и вне троп.
Таким образом, включение AII в кругообороте палочки (scotopic (ночное освещение) условия) требуется для вертикального потока информации в пределах IPL, поскольку это функционирует, чтобы усилить сигнал, быстротечность увеличения, и уменьшить шум до достижения клеток нервного узла. В управляемых колбочкой кругооборотах, входы от НА-СИ-БИ-СИ непосредственно стимулируют AIIs и НА-НЕРВНОМ-УЗЛЕ клетки. Ответ AII - деполяризация, со здравым НА-ЦЕНТРЕ ответом, приводя к глициновому выпуску и запрещению ответов вне типа. Эти входы glycinergic к постсинаптической Си-би-си и/ИЛИ клеткам нервного узла позволяют НА-СИГНАЛАХ преобладать во внутренней сетчатке при этих условиях. Таким образом, AII всегда получает входы, хотя тип входа изменяет (в зависимости от интенсивности стимула) то, чтобы заставлять клетку AII переместить ее центр от одной тропы входа до другой и от одной функции до другой. Таким образом, зрительные сигналы палочек и колбочек управляются амакриновыми клетками внутри сетчатки, что даёт ыозможность колбочкам работатать при дневном освещении, а палочкам — при сумеречно-ночном.
См. также[править | править код]
Примечания[править | править код]
- ↑ https://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Retina_layers.svg
- ↑ «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.
- ↑ http://bse.sci-lib.com/particle027003.html
- ↑ Polyak S. 1957. The vertebrate visual system. Chicago.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Стр. 16
- ↑ Перейти обратно: а б в г д е ё ж з Mahnoosh Farsaii and Victoria P. Connaughton. "AII Amacrine Cells". Webvision. Дата обращения: Лаборатория доктора Марка,28 сентября, 2012.
{{cite web}}: Проверьте значение даты:|accessdate=(справка)К:Википедия:Ошибки CS1 (даты)