Метод локальной фиксации потенциала
Метод локальной фиксации потенциала, patch-clamp (англ. patch — заплатка, clamp здесь — захват, фиксация) — электрофизиологическая методика для изучения свойств ионных каналов, состоящая в том, что фрагмент клеточной мембраны изолируется с помощью специальной пипетки. Эта методика дает возможность экспериментатору контролировать разность потенциалов между сторонами мембраны, а также помещать ее в среду с определенным химическим составом. В этих хорошо контролируемых условиях измеряют ионные токи, проходящие через мембрану, что, в конечном итоге, позволяет делать выводы о том, как ионные каналы реагируют на электрическое и химическое воздействие. Метод настолько чувствителен, что позволяет наблюдать поведение и химические превращения единичных молекул, взаимодействующих с мембраной. Разработаны экспериментальные протоколы, позволяющие измерять характеристики ионных каналов оптимальным образом. Немецкие исследователи Эрвин Неэр и Берт Закман (Erwin Neher и Bert Sakmann), разработавшие эту методику, получили Нобелевскую премию (1991 г.).
Задача: исследование трансмембранных ионных токов[править | править код]
Живые клетки покрыты мембраной, структурную основу которой составляет двойной слой липидов, слабо проницаемый для воды и практически непроницаемый для ионов. Каждая клетка должна обмениваться с внешней средой различными веществами и, в частности, ионами. Перенос ионов через мембрану играет важную роль в процессах возбуждения клетки и передачи сигналов. Ионы проникают в клетку и выходят из нее через встроенные в мембрану белковые структуры — каналы и транспортёры.
Транспортёры — это мембранные белки, которые соединяются с переносимым веществом по одну сторону мембраны, переносят это вещество через мембрану и затем его освобождают. Такой перенос становится возможным потому, что в результате соединения с веществом транспортёр меняет конформацию (то есть форму, ориентацию). Бытовой аналогией транспортёра является лифт, который «присоединяет» к себе людей, переносит их на другой этаж и «освобождает». Важнейший транспортёр в клетках эукариот — это натрий-калиевый насос. Для работы этого насоса требуется энергия, которую он черпает из запасённой в клетке АТФ. За один цикл своей работы насос выводит из клетки 3 иона Na+ и вводит в неё 2 иона K+. Одна молекула этого транспортёра совершает примерно 103 циклов в секунду. Сходная частота циклов характерна и для других видов транспортёров.
Каналы — это белки, которые выполняют функцию мембранных пор, так как формируют отверстия, сквозь которые могут проходить ионы. Мембранные каналы селективны — проницаемы только для определенных веществ. Селективность обусловлена радиусом пор и распределением заряженных функциональных групп в них. Существуют каналы, селективно пропускающие ионы натрия (натриевые каналы) и ионы калия (калиевые каналы), а также хлоридные каналы. Для каждого вида ионов существует не один, а довольно много видов каналов. Сквозь один канал за секунду проходит 106 — 107 ионов.
Несмотря на фундаментальные различия в механизме транспорта через каналы и транспортёры, они могут быть образованы высокогомологичными белками. Так, недавно получены данные, что мутация единственной аминокислоты в белке транспортёра двухвалентных металлов DMT1 приводит к его превращению в кальциевый канал . Кроме того, существует по крайней мере один транспортёр (хлорид-бикарбонатный обменник эритроцитов), осуществляющий 105 переносов в секунду, что очень близко к скоростям, характерным для каналов, и заставляет предположить существование у него некоего «промежуточного» между каналами и транспортёрами механизма.
Так как ионы — это электрически заряженные молекулы, при их переходе через мембранные каналы переносится и заряд, а значит, через мембрану течет электрический ток. Этот ток можно измерить. Чем больше разность потенциалов между сторонами мембраны, тем больше ток. Проводимость (отношение тока к разности потенциалов) одиночного канала в открытом состоянии варьирует в зависимости от вида канала, от 1—2 до 30—50 пикосименсов. Это значит, что при разности потенциалов, равной 100 мВ, через канал потечёт ток в несколько пикоампер.
Решение: история вопроса[править | править код]
Один внутриклеточный электрод. Измерение разности потенциалов[править | править код]
Первоначально электрические явления на клеточных мембранах измеряли с помощью острых стеклянных микроэлектродов, вводившихся в клетку. Техника с одним внутриклеточным электродом позволяет измерять разность потенциалов или ток, но не даёт возможности фиксировать их на определенном уровне, так что во время исследования одновременно меняются оба параметра. Кроме того, классические острые микроэлектроды дают возможность измерения исключительно на целой клетке, которая имеет, как правило, различные типы белков и транспортёров. Все это, вместе взятое, сильно затрудняет интерпретацию данных, полученных таким методом.
Двухэлектродная фиксация потенциала[править | править код]
Тот факт, что фиксация трансмембранного потенциала позволит измерять мембранную проводимость по изменениям тока при постоянном напряжении, был впервые осознан еще в 30-х гг. XX века, и тогда же английские исследователи Алан Ходжкин и Эндрю Хаксли (Alan Hodgkin and Andrew Huxley) начали эксперименты с двухэлектродной фиксацией потенциала (2-electrode voltage clamp).
Суть метода состоит в следующем. В клетку вводятся два электрода, ещё один — электрод сравнения — остается вне клетки. Первый внутриклеточный электрод служит для измерения трансмембранной разности потенциалов (то есть разности потенциалов между ним и электродом сравнения), второй может подавать ток. Специальное устройство — генератор сигнала — задает командный потенциал, которому должен быть равен трансмембранный потенциал. Измеренный трансмембранный потенциал подается на вход устройства сравнения, которое вычитает измеренный потенциал из командного и, в зависимости от величины разности, подает ток на токовый электрод так, чтобы скомпенсировать эту разницу. Монитор тока, в свою очередь, постоянно измеряет величину тока, которая для этого необходима. В 1930-х и 40-х годах, когда работали Ходжкин и Хаксли, не существовало микроэлектродов, поэтому в качестве внутриклеточных электородов использовались тонкие проволоки. Это определило выбор объекта — единственной животной клеткой, в которую можно было ввести две изолированные друг от друга проволоки, был гигантский аксон кальмара. На этом объекте методом двухэлектродной фиксации потенциала исследователи выполнили эксперименты, в которых была установлена ионная природа потенциала действия и впервые постулировано существование ионных каналов (Нобелевская премия 1963 г., поделена с Дж. Экклзом, получившим ее за исследования в области синаптической передачи). Двухэлектродная фиксация потенциала применяется и в настоящее время, с использованием острых стреклянных микроэлектродов, однако даже с ними эта методика имеет существенные ограничения: во-первых, два электрода могут быть введены только в весьма крупную клетку (например, ооцит лягушки), во-вторых, она позволяет измерять проводимость всей клеточной мембраны, со всеми, как правило разнородными, каналами в ней.
Решение: patch-clamp, его варианты и конфигурации[править | править код]
Гигаомный контакт[править | править код]
В конце семидесятых годов XX в. E.Neher и B.Sakmann обнаружили, что если стеклянной пипеткой с диаметром 1—2 микрона коснуться клеточной мембраны, то на границе «мембрана — стекло» образуется контакт с сопротивлением в несколько гигаом — это так называемый гигаомный контакт. Он позволяет изолировать от внешней среды и от остальной части мембраны тот ее фрагмент, который находится внутри пипетки. Отграниченный пипеткой фрагмент мембраны и называется patch — «заплатка», слово clamp (фиксация) в названии метода имеет два значения:
- захват и изоляция этой «заплатки»;
- фиксация трансмембранного потенциала или тока в изолированном фрагменте, или, как будет описано позже, целой клетке.
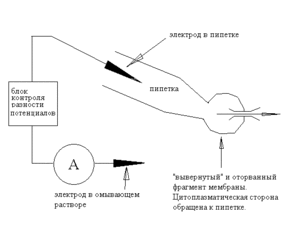
В пипетку, заполненную раствором электролита, помещается хлор-серебряный электрод, второй электрод размещается внеклеточно, в омывающей жидкости. Отличие электрической схемы от ранее описанной для двухэлектродной фиксации заключается в том что один и тот же электрод используется как для измерения разности потенциалов, так и для подачи тока. В основе установки, тем не менее, по-прежнему лежат усилитель мембранного потенциала, блок сравнения и монитор тока.
На фото 1 показана часть такой установки.
Огромная сфера, часть которой видна на мониторе в центре фотографии — это клетка (ооцит лягушки Xenopus laevis), находящийся в данный момент на предметном столике микроскопа, к нему подведена patch-пипетка, ее диаметр у носика — около 3 микрон. После установления гигаомного контакта она изолирует фрагмент мембраны площадью приблизительно 7 мкм2, и если в этом фрагменте окажутся ионные каналы, их ток можно будет записывать.
Конфигурация «Cell-attached»[править | править код]
Только что описанная конфигурация называется cell-attached patch-clamp (patch-clamp «на клетке»). Она иллюстрируется схемой 2.
Эта конфигурация, однако, имеет два неудобства.
Во-первых, она не позволяет с достаточной надёжностью измерять, а, следовательно, и задавать трансмембранную разность потенциалов — поскольку оба электрода — как пипеточный, так и внешний, находятся по одну сторону мембраны. Вообще говоря, можно, используя омывающий раствор с ионной композицией, повторяющей состав цитоплазмы, деполяризовать мембрану вне пипетки, так что разность потенциалов между внешним электродом и цитоплазмой исчезнет, а тогда разность потенциалов между электродами окажется равна трансмембранному потенциалу — но все это весьма приблизительно, так как точный состав цитоплазмы нам неизвестен.
Во-вторых, эта конфигурация не позволяет контролировать состав среды вне пипетки — там остаётся цитоплазма, состав которой не вполне определён.
В силу этих причин cell-attached mode применяется довольно ограниченно.
Конфигурация Inside-out[править | править код]
Однако, если пипетку быстрым движением отвести от клетки, то «внутренний» кусочек мембраны оторвется от клетки и получится конфигурация inside-out (наружная сторона внутри), названная так потому, что внутренняя, обычно обращенная к цитоплазме, сторона мембраны окажется снаружи — в омывающем растворе, а наружная — внутри пипетки. (Схема 2.) Альтернативный метод перехода в конфигурацию inside-out заключается в следующем: из конфигурации cell-attached пипетку отводят плавно, формируя с двух сторон закрытую везикулу; затем поднимают пипетку в воздух и опускают во вторую ванночку, с внутриклеточным раствором. При переносе внешняя мембрана везикулы разрушается, в результате формируется конфигурация inside-out.
Теперь разность потенциалов на фрагменте мембраны строго равна разности потенциалов между электродами. Очевидно, что при использовании такой модификации пипетку заполняют раствором, имитирующим внеклеточную среду, тогда как омывающий раствор делают близким по составу к цитоплазме. При этом, меняя состав омывающего раствора, можно изучать, как такие изменения в цитоплазме влияют на ток интересующих нас каналов — ведь омывающий раствор контактирует с цитоплазматической стороной мембраны).При этом мы точно знаем как состав жидкости по обе стороны мембраны, так и разности потенциалов, что позволяет достаточно точно характеризовать каналы, используя уравнения Нернста и Гольдмана-Ходжкина-Каца, так что на этом уровне электрофизиология превращается в биофизику каналов. При этом, если в изолированный участок мембраны попал один канал, то мы наблюдаем поведение единичной молекулы и, если это лиганд-регулируемый канал-рецептор, то её взаимодействие с другими единичными молекулами.
Конфигурация Whole-cell[править | править код]
Если по условиям эксперимента необходимо менять состав внеклеточной среды, можно использовать конфигурацию whole cell («англ. целая клетка»). В этом случае пипетку не отводят от клетки, а подают в неё отрицательное давление и таким образом разрушают изолированный фрагмент мембраны.
После этого пипетка соединена с внутриклеточной средой; поскольку клетка обычно маленькая, то, благодаря диффузии, состав цитоплазмы вскоре оказывается идентичным составу пипеточного раствора, поэтому мы, как и в предыдущем случае, знаем как состав жидкостей, так и разность потенциалов. Отметим, что если в конфигурации inside-out пипеточный электрод был внеклеточным, а внутренний — внутриклеточным, то теперь их роли изменились, так что, задавая потенциал, необходимо инвертировать полярность. Преимущество этого метода состоит и в том, что здесь оказываются сохранны все клеточные структуры и регуляторные механизмы. Но есть и недостаток — мы измеряем суммарный ток всех каналов в клетке, между тем, одно из главных достоинств patch-clamp состоит в возможности изучения отдельных молекул.
Конфигурация Outside-out[править | править код]
Решить эту проблему позволяет конфигурация outside-out (наружная сторона снаружи). Если после перехода в whole-cell mode медленно отводить пипетку от клетки, мембрана не отрывается сразу, а начинает вытягиваться в трубку — это видно на фото 5.
Обратите внимание — в пипетке отчетливо видны кусочки цитоплазмы, попавшие туда после разрушения мембраны при переходе в whole-cell.
Следующая фаза процесса представлена на фото 6.
Мембранная трубка стала совсем тонкой и почти невидима («протуберанец» у поверхности клетки — это небольшая часть цитоплазмы, оставшаяся в мембранной трубке). В следующее мгновение трубка порвётся, а мембрана сомкнется на пипетке в «вывернутом» виде — мы окажемся в конфигурации «outside-out»
Итак, пипетка и ее электрод — подобно конфигурации whole-cell — внутриклеточные, мы свободно меняем состав внеклеточного раствора, площадь исследуемой мембраны невелика, так что мы вновь можем изучать одиночные каналы.
Perforated patch[править | править код]
Perforated patch («продырявленный patch»)— это специфический вариант patch-clamp в whole-cell mode. В данном случае, после формирования гигаомного контакта в пипетку подаётся новый раствор, содержащий небольшое количество специального антибиотика, например, Амфоторецина-В либо Грамицидина. Антибиотики этого класса образуют отверстия в клеточной мембране на участке, присоединённом к электроду.
Такой подход позволяет избежать замещения внутренней среды клетки раствором из пипетки-электрода, то есть клетка остаётся живой с минимальными, насколько это возможно, повреждениями. Таким образом, ответы клетки на раздражители являются максимально приближёнными к естественным. В то же время, данному методу присущ ряд недостатков. Во-первых, по сравнению с классическим whole-cell mode, электрическое сопротивление доступа (которое состоит из сопротивления пипетки и сопротивления в месте соединения пипетки с мембраной) является значительно более высоким. Это понижает уровень распознавания электрического тока, повышает уровень шума при записи, и экспоненциально увеличивает значения всех ошибок, связанных с флюктуациями сопротивления полной цепи (от электрода во внешнем растворе до электрода в пипетке). Во-вторых, для того, чтобы антибиотик подействовал, требуется довольно много времени (до 30 минут), что существенно уменьшает полезный период эксперимента. И, в-третьих, антибиотик повреждает мембрану также и в месте соединения с кончиком пипетки, что приводит к ускоренному разрушению гигаомного контакта и дополнительно уменьшает эффективное экспериментальное время. Таким образом, данный вариант метода может быть с успехом использован только в экспериментах, которые не требуют продолжительного времени для выявления исследуемых явлений.
Nuclear patch[править | править код]
Интересная разновидность patch-clamp — nuclear patch. (Фиксация потенциала с клеточным ядром).
Этот метод применяется в случае, когда количество исследуемых каналов на поверхности мембраны мало. Основной целью данного метода является повышение вероятности попадания единичного рецептора на пипетку путём увеличения площади отрываемого от клетки участка мембраны; сам же метод состоит в следующем. Пипетка подводится к клетке, а затем рывком пробивает мембрану. После этого кончик пипетки подводится к клеточному ядру, на пипетку подается небольшое отрицательное давление. В результате пипетка присасывается к ядру. Затем пипетка с ядром на конце плавно отводится назад и вынимается из клетки. Пипетку необходимо вывести из клетки таким образом, чтобы участок мембраны в месте выхода «наделся» на присосавшееся ядро и оторвался, обернувшись вокруг него. В результате получается специфический вариант outside-out patch, при котором гораздо больший, чем в обычном варианте метода, участок мембраны присоединён к концу пипетки, будучи обёрнутым вокруг клеточного ядра. Таким образом, вероятность нахождения нужного единичного рецептора на оторванном участке мембраны заметно повышается.
Фиксация потенциала и фиксация тока[править | править код]
Когда изучаются изменения проводимости однотипных каналов в ответ на какие-то химические воздействия или зависимость их проводимости от разности потенциалов на мембране, удобно фиксировать потенциал и измерять ток канала — как мы до сих пор и описывали. Этот, самый частый вариант patch-clamp, называется voltage clamp (фиксация потенциала). Однако, иногда исследователя интересуют процессы трансмембранного переноса ионов, связанные с изменением мембранного потенциала — например, проведение нервного импульса. В таких случаях можно поступить противоположным образом: зафиксировать на постоянном уровне ток (например, можно предположить, что суммарный ток через все ионные каналы в каждый момент времени равен нулю, соответственно установить нулевой ток), и изучать изменения разности потенциалов при этом. Такой вариант называется current clamp (фиксация тока).
Примеры записей, получаемых методом patch-clamp[править | править код]
Запись одиночного канала рецептора глицина. Чётко видны два состояния: закрытое (ему соответствует нулевой ток) и открытое (ему соответствует ток примерно в 7 пикоампер). Канал время от времени спонтанно переходит из одного состояния в другое, промежуточных состояний нет. Запись позволяет получить две важнейшие характеристики канала: проводимость (исходя из величин трансмембранного потенциала и тока) и вероятность нахождения в открытом состоянии (определяемое как отношение времени, когда канал открыт к времени, когда он закрыт). К слову, чаще всего активность канала физиологически регулируется путем изменения этой вероятности).
Запись в конфигурации whole-cell. Клетка эпителия собирательной трубки. Трансмембранный потенциал −60 мВ. С интервалами в 1 минуту на 30 секунд в омывающий раствор вводится амилорид — ингибитор эпителиального натриевого канала. Кстати, чувствительность к ингибиторам — это еще одна из важнейших характеристик канала. Введение амилорида всякий раз приводит к падению тока до нуля, из чего следует, что практически вся проводимость при −60 мВ в данной клетке — это проводимость эпителиального натриевого канала. В противоположность предыдущей записи, изменения тока выглядят непрерывными — это связано с тем, что одновременно записывается много каналов (около 2000), соответственно, имеется примерно 2000 уровней тока — от «все открыты» до «все закрыты».
Литература[править | править код]
- Шаблон:±. Single-channel recording. — 1995.
- Microelectrode techniques: The Plymouth workshop handbook. — изд. 2-е. — Cambridge, UK: Company of Biologists, 1994. — ISBN 0948601493.
Ссылки[править | править код]
| Первоисточник этой статьи был признан «хорошей статьёй» русского раздела Википедии. |