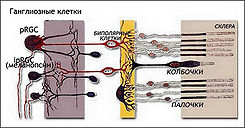
Зрительная фототрансдукция фоторецепторов сетчатки глаза
Зрительная фототрансдукция или Фототрансдукция в палочках и колбочках — физиологический процесс создания и трансформации биохимических нервных сигналов при формировании оптического изображения в процессе зрения позвоночных животных. Процесс этот начинается от захвата фотонов сетчаткой глаза, и завершается формированием зрительных образов в зрительной коре головного мозга.[1]
Введение[править | править код]
| Нейроны сечения сетчатки Палочек, Колбочек, ipRGC | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
(Клетки при большом увеличении). | ||||||||||||
| ||||||||||||

Фоторецепторные клетки сетчатки глаза или фоторецепторные клетки нейронов — специализированный тип нейронов в сетчатке глаза, способный к фототрансдукци зрительного сигнала. Важное биологическое значение фоторецепторов состоит в том, что они преобразуют свет (версия Миг) (видимое электромагнитное излучение) в сигналы, которые могут стимулировать биологические процессы. Боле конкретнее, это — способность фоторецепторных белков в клетке поглощать фотоны, вызывая в клетке потенциал в том числе и мембранный потенциал.[2] (Cм. также Фотохимические реакции).
Формирование оптического изображение в процессе зрения у позвоночных животных связано с находящимися к сетчатке глаза фоторецепторных клеток — экстерорецепторов колбочек (cone) и палочек (rod). Колбочки и палочки в то же время работают при участии ганглиозных фоторецепторов ipRGC, расположенных в сетчатке вне фокальной поверхности, которые непосредственно не формируют оптическое изображение, но принимают участие в работе колбочек и палочек. Палочки специализированы для «низко-легкого» зрения. Они чрезвычайно чувствительны и могут сигнализировать поглощение одиночных фотонов. Колбочки обеспечивают видения дневного света (иллюстрация 1). Они намного менее чувствительны к свету, чем палочки, но обладают более длительным временным восприятием. Они также обеспечивают цветное зрение благодаря способности колбочек воспринимать сфокусиванные на них лучи света из-за изменчивых фотопигментов у них, чувствительных к различным спектральным лучам (См. Опсины (версия Миг)).
- Рис. 1. Светлопольные изображения фоторецептора палочки и фоторецепторов колбочки, изолированных от сетчатки саламандры. Фототрансдукция имеет место во внешней доле, в то время как эллипсоид плотно упакован mitochondria. Палочки ответственны за тусклое легкое видение, колбочки для видения яркого света.
Имеются большие достижения в понимании фототрансдукции палочки. Начиная с введения электрода всасывания, позволяющего производить запись техники при экспериментах в конце 1970-ых (Baylor и др., 1979a). Фоторецепторы человека, земноводных и относящиеся к млекопитающим (включая примата), могут быть использованы для исследоаний этим методом. Бычья сетчатка, с другой стороны, была любимой при подготовке к тому, чтобы изучить фототрансдукцию биохимиками из-за изобилия доступной ткани. Мышь, однако, стала более популярной моделью животных для исследования в прошлом десятилетии при помощи появившихся планируемых генных методов. Когда это объединено с электрофизиологией, генетика мыши обеспечивает непревзойденную власть в объяснении в естественных условиях функции ключевых белков фототрансдукции, большинство которых было выбито, сверхвыражено или видоизменено в колбочках, приводя к богатому объему информации на принципах, лежащих в основе увеличения, восстановления и адаптации фотоответов палочка/колбочка (Таблица 1, рис. 2,3).
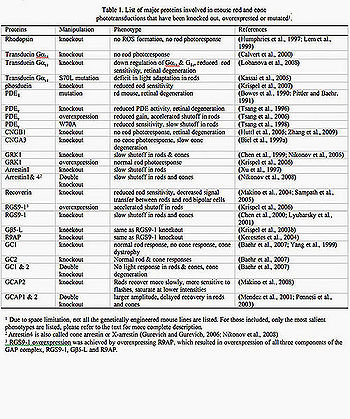
Таблица 1. Список главных белков, вовлеченных в палочке мыши и фототрансдукции колбочки, которые были выбиты, сверхвыражены или mutated1 1) из-за высокого ограничения, но не все генетически проектируемые линии мыши перечислены. Для включенных только перечислены самые существенные фенотипы (в тексте дано более полное описание). 2) Arrestin4 также называют колбочкой-arrestin или X-arrestin (Gurevich и Gurevich, 2006; Никонов и др., 2008) 3) сверхвыражение RGS9‒1 было достигнуто сверхвыражением R9AP, который привел к сверхвыражению всех трех компонентов комплекса ПРОМЕЖУТКА, RGS9‒1, G_5-L и R9AP.
Сначала даётся краткое описание структуры и развития фоторецепторов мыши, сопровождаемых резюме недавних исследований фототрансдукции палочки с акцентом на информацию, подбираемой от образцов мыши. В конце, будет упомянут недавний прогресс в обучающихся колбочках мыши.
Структура и функция палочек и колбочек[править | править код]
Палочки составляют ~97 % фоторецепторов глаза мыши сетчатки глаза, колбочки — остальное (Картер-Доусон и LaVail, 1979). Фоторецепторы мыши подобны фоторецепторам примата в физических измерениях (Стол 2 и иллюстрация 2). Внешняя доля — приблизительно 1.4мкм в диаметре и 24мкм в длине для палочек, и, соответственно, приблизительно 1.2мкм. и 13мкм. для колбочек. Эти величины являются значительно меньшими, чем у фоторецепторов земноводных (иллюстрация 1), которые объясняют давнюю пользу физиологов для исследований последних.

- Таблица 2. Физические измерения внешней доли палочек мыши и колбочек Саламандра, а фоторецепторы примата включены для сравнения.
Палочки и колбочки имеют четыре первичных структурных/функциональных областей: внешняя доля мембраны, внутренняя доля мембраны, тело ячейки и синаптический терминал. Внешняя доля мембраны связана с внутренней долей через тонкую соединительную ресницу. Внешняя доля является заполненной плотным прозрачным веществом мембранных дисков (иллюстрации 2 и 3), разделённой промежутками в приблизительно в 28 нм. Диски несут визуальный пигмент опсин (разновидность фотопигментов «rhod-opsin» в палочках и разновидность фотопигментов колбочки «con-opsin» в колбочках)[3] и других компонентах трансдукции или как трансмембранные или периферийные мембранные белки (иллюстрация 3). Зрительный фотопигмент — самый насыщенный белок во внешней доле (мембране). Важность визуального пигмента как главного структурного компонента демонстрируется у мыши rhodopsin-нокаута, в палочке, где внешние доли мембраны не в состоянии сформироваться (Humphries и др., 1997; Лем и др., 1999). Фоторецепторы палочки у этой мыши — выродившийся сопровождаемый представитель колбочек. Упаковочная плотность молекул пигмента на дисках мембраны необычно однородна поперек различных позвоночных разновидностей, содержашихся на площади ~25000 мм², соответствуя концентрации ~ 3mM (Harosi, 1975). Общее количество молекул пигмента во внешней доле может таким образом быть вычислено примерно от ее объема конверта. Плотный стек дисков очень увеличивает вероятность захвата фотона. Интересное различие между палочками и колбочками — это то, что диски палочки (за исключением возникающих дисков в основе внешней доли мембраны) полностью усвоены и поэтому физически отделены от плазменной мембраны, тогда как диски колбочки остаются свёрнутыми плазменной мембраной. Открытые диски колбочки предлагают намного большую поверхностную область для быстрых потоков веществ между внешностью клетки и интерьером, по типу передачи хромофора для регенерации фотопигмента и быстрой динамики кальция в течение световой лёгкой адаптации или возбуждения волны сигнала — мембранного потенциала.


- Рис. 2. Низкое усиление изображений палочек и колбочек обезьяны с расширением внешних дисков (мембран) доли.
- Рис.3. Схематическая диаграмма rhodopsina во внешних дисках (мембран) доли.
Внутренняя доля фоторецепторов содержит endoplasmic сеточку и аппарат Golgi. Это также упаковано mitochondria, близко, смежно с внешней долей (иллюстрации 2 и 3), чтобы обеспечить высокий спрос на метаболическую энергию, связанную с фототрансдукцией. Все белки, предназначенные для внешней доли, должны пройти через узкую зону соединительной ресницы между внешним и внутренними долями.
Синаптический терминал передает световой сигнал к нейронам второго заказа в сетчатке: к биполярным и горизонтальным ячейкм. В темноте есть устойчивый внутренний поток («темный поток») через проводимость катиона на мембране внешней доли (Hagins и др., 1970), деполяризуя палочку или колбочку и поддерживая устойчивый синаптический выпуск глутамата. Свет закрывает эту проводимость катиона («светочувствительная» проводимость, состоя из cGMP-gated каналов) служит, чтобы остановить темный поток и произвести мембранную гиперполяризацию как ответ. Эта гиперполяризация уменьшает или заканчивает тёмный глутаматный выпуск. Сигнал далее обрабатывается другими нейронами в сетчатке прежде, чем передаётся в высшие отделы зрительных центров в мозге.
Завершение фототрансдукции R*[править | править код]
Активизированный rhodopsin (R *) инактивирован двухступенчатым процессом. Сначала, R* — phosphorylated rhodopsin киназой (GRK1), который понижает деятельность R*. Во вторых, белок arrestin (Arr1) связывает с phosphorylated R *, увенчивая его остаточную деятельность (Kuhn и Wilden, 1987; Wilden и др., 1986).
Многократные остатки серина/треонина в C-терминале rhodopsin (шесть в мышах и семь в людях) обеспечивают участки фосфорилирования для GRK1. Пигменты колбочки имеют больше потенциальных участков фосфорилирования в C-терминале, чем rhodopsin. Например, человеческий красный пигмент колбочки имеет 10 таких участков. Даже при том, что биохимические эксперименты первоначально вскрыли, что rhodopsin — преобладающе phosphorylated только в одном остатке серина после легкого подвергания (Ohguro и др., 1995), и последующая регистрация от трансгенных палочек мыши, несущих мутации участка фосфорилирования показала, что восстанавливаемая дезактивация R* требует по крайней мере трех событий фосфорилирования (Mendez и др., 2000). Кроме того, все шесть участков должны быть phosphorylated для нормального снижения ответа, чтобы перейти в другое состояние.
Многократные события фосфорилирования также предложили, что бы находиться в состоянии воспроизводимости ответов палочки на одиночные фотоны (Gibson и др., 2000; Hamer и др., 2003; Mendez и др., 2000). Несмотря на то, что события, произведенные одиночными молекулами являются стохастическими в природе, ответ палочки на одиночный фотон показывает замечательную воспроизводимость в амплитуде и форме (Baylor и др., 1979b; Rieke и Baylor, 1998; Whitlock и Ягненок, 1999). Составляя в среднем по многократным шагам отключения, интегрированная деятельность R* изменяет меньше, чем иначе управляемый единственным шагом. Эта гипотеза поддержана экспериментами, используя трансгенные палочки мыши, несущие мутации участка фосфорилирования (Doan и др., 2006). Авторы показали, что воспроизводимость ответа единственного фотона изменяется по градуируемой и систематической манере с числом, но не идентичностью, участков фосфорилирования. Каждый участок фосфорилирования обеспечивает независимый шаг в родопсин (версия Миг) (rhodopsin) дезактивации и что, все вместе, эти шаги сильно управляют целой жизнью R*.
Намного меньше известно о роли участков фосфорилирования в пигментах колбочек. Единственные в естественных условиях эксперименты, которые были сделаны Кефаловым и др. (Кефалови др., 2003), показывали, что трансгенные палочки лягушки, выражающие человеческий красный пигмент колбочки всеми 10-ю предполагаемыми видоизмененными участками фосфорилирования дали длительный ответ. Это говорит о том, что активизированный пигмент колбочки подавлен подобным двухступенчатым механизмом отключения даже при том, что его активная целая жизнь намного короче, чем та же на базе rhodopsin.
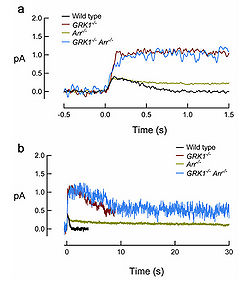
- Иллюстрация 13. Форма ответа от единственного фотона у прутов мыши при нокауте вспышкой с несовершенным завершением R* на быстром (a) и медленные (b) весы времени. Вспышки поставляли в t = 0. (Любезность Мэри Э. Ожоги).
В дополнение к мутациям всего серина C-терминала и остатков треонина аланина (Mendez и др., 2000), фосфорилирование родопсина может также быть предотвращено, удаляя область C-терминала пигмента (Chen и др., 1995b) или удаляя GRK1 (Chen и др., 1999). Как ожидается, палочки от всех трех трансгенных линий мыши показали подобные свойства ответа от единственного фотона, с амплитудой, достигающей плато в два раза большим, чем от дикого типа и распадающегося основательно stochastically после длинного интервала в 3 — 5 секунд. GRK1 установленное фосфорилирование начинает уменьшать деятельность R* в ~100 мс после вспышки, потому что это — пункт времени, в котором трансгенный ответ начинает отклоняться от ответа ВЕСА (иллюстрация 13). Как упомянуто ранее, это было оценено в недавнем исследовании, что целая жизнь R* — ~80 мс (Krispel и др., 2006), предлагая, что закрепление arrestin происходит быстро после фосфорилирования пигмента. Поэтому, GRK1/arrestin был посредник, отключение происходит в прутах еще ранее чем быстрая Мета ВТОРОЙ распад пигмента конуса (Кефалов и др., 2003), который имеет заказ 1 s после вспышки (Imai и др., 1997; Kuwayama и др., 2002; Shichida и др., 1994). GRK1-установленное отключение вероятно случается еще быстрее в конусах (см. ниже).
Мышь и крыса необычны в этом, и тот же самый GRK1 присутствует и в палочках и в колбочках. Во всех других изученных разновидностях, другая киназа пигмента (так называемая «киназа пигмента колбочки»), GRK7, присутствует в фоторецепторах колбочки (Rinner и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Weiss и др., 2001). Действительно, много разновидностей животных, включая человека, имеют и GRK1 и GRK7 в конусах. Это объясняет, почему пациенты Oguchi с дефектным геном GRK1 имеют нормальное дневное видение, тогда как GRK1-пустые мыши продлили фотоответы колбочки (Lyubarsky и др., 2000; Никонов и др., 2005). Интересно, GRK7 показывали, чтобы иметь значительно выше определенную деятельность чем GRK1 и, в рыбе, присутствует при намного более высокой концентрации в колбочках, чем GRK1 находится в палочках (Tachibanaki и др., 2005; Wada и др., 2006). Это различие было предложено как потенциальный механизм, лежащий в основе более быстрого отключения и более низкой чувствительности колбочек, чем палочек (рассмотренный в Tachibanaki и др., 2006).
Биохимические эксперименты предлагают, что GRK1 — установленное фосфорилирование R* регулируется recoverin (Rec) (Chen и др., 1995a; Kawamura, 1992, 1993; Klenchin и др., 1995), который принадлежит семье обязательных белков с кальцием. Гипотеза о том, что, когда внутриклеточная свободная Приблизительно2+ концентрация высока в темноте, Rec-приблизительно2+ связывает с GRK1 и запрещает фосфорилирование R*. Когда Приблизительно2+ концентрация уменьшается на свету, Приблизительно2+ отделяет от recoverin; следовательно, получающаяся близость между recoverin и GRK1 уменьшена, и его запрещение на фосфорилировании R* выпущено. Однако, этой гипотезе бросали вызов с размерами в пробирке, предлагающие, что степень фосфорилирования R* была незатронута легкой адаптацией и изменениями во внутриклеточном Приблизительно2+ [130]. Это противоречие было наконец улажено регистрацией от Rec-/- палочки мыши (Makino и др., 2004), который показал, что этот Rec-приблизительно2+ продлевает адаптировавшийся к темноте ответ вспышки и увеличивает чувствительность палочки к тусклому устойчивому свету, вероятно, запрещая фосфорилирование R* GRK1. Кроме того, Rec-/- палочки имели более быструю Приблизительно2+ динамику, указывая, что recoverin является существенным Приблизительно2+ буфером в ПЗУ.
Во втором шаге для дезактивации R *, arrestin обязывает с phosphorylated R* (R*-P) завершать с успехом его каталитическую деятельность. У мыши, ответы тусклой вспышки от палочек arrestin-нокаута (Прибытие-/-) мыши не отличаются очень от ответа дикого типа до ммомента его падающей фазы, когда восстановление достигает приблизительно на полпути назад к основанию (Ксу и др., 1997). Поэтому, фосфорилирование одно может уменьшить R* 's деятельность значительно. Ответ Прибытия-/- палочки в среднем оправляются в ~10 раз более медленно, чем ответ прутов, испытывающих недостаток rhodopsin фосфорилирование (иллюстрация 13), по-видимому отражая непрерывную деятельность phosphorylated Меты ВТОРОЕ государство R*, пока это не распадается к бездействующей Мете III. В прутах, испытывающих недостаток и GRK1 и arrestin (GRK1-/-Прибытие-/-), фаза активации и пиковая амплитуда ответа тусклой вспышки напоминают таковые из GRK1-/- палочки, но тогда GRK1 и arrestin (GRK1-/-Прибытие-/-) распадаются медленно со временем, постоянно подобный тому из Прибытия-/- ответ (Ожоги и др., 2006), отражая распад non-phosphorylated R. Таким образом кажется, что фосфорилирование не влияет на распад R*.
По крайней мере два соединённых варианта существуют для палочки arrestin: во всю длину (p48) и C-терминал обрезанная форма (p44) (Смит и др., 1994). P44 имеет более быстрый на-норме, чем p48 для того, чтобы связать R* и R*-P (Palczewski и др., 1994; Pulvermuller и др., 1997). Кроме того, p44 более эффективен чем p48 в выключении R* в пробирке (Langlois и др., 1996; Palczewski, 1994). Хотя p48 в ~10 раз более изобилен, чем p44, это перемещает от ПЗУ до остальной части ячейки в темноте, поэтому в значительной степени отсутствуя в адаптировавшемся к темноте ПЗУ (Broekhuyse и др., 1985; Mangini и Pepperberg, 1988; Philp и др., 1987; Whelan и McGinnis, 1988). Это поднимает интересный вопрос о ролях индивидуального isoforms arrestin в неповрежденных палочках. Выборочно выраженная двумя isoforms в палочках мыши, испытывающих недостаток в эндогенном arrestin, получалось, что оба isoforms могли подавить деятельность phosphorylated R* быстро. Однако, только p48 был в состоянии подавить деятельность non-phosphorylated R* (Ожоги и др., 2006).
Колбочки показывают их собственный arrestin, названный колбочка- arrestin или X-arrestin (Arr4) (Ремесло и Whitmore, 1995; Murakami и др., 1993). Удивительно, и от палочки и от колбочки формы arrestin существуют в колбочках мыши (Zhu и др., 2005). Arr1 в колбочках является в ~50 раз выше, чем тот из Arr4 (Никонов и др., 2008). Одиночная регистрация клетки колбочек мышей с одним или обоими arrestins выбила показы, что arrestin требуется для нормального состояния клетки.
Т.о. можно утверждать, что колбочки-S наряду с палочками функционируют в зоне фиолетово-синего спектра. При этом, при дневном освещении — работают колбочки, при слабом освещении — палочки (см. иллюстрация 13).
Модель фототрансдукции колбочки мыши[править | править код]
Недавно были достигуты существенные успехи в понимании фототрансдукции колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Учитывая огромный успех в изучении фототрансдукции палочки за счёт комбинации генетики мыши и электрода всасывания в посдеднее время, позволяющих делать запись в исследованиях при использовании мыши, данная методика стала образцовой системой для изучения фототрансдукции колбочки. Что до недавнего времени ограничивало исследования ЭРГА (так как процент колбочек в сетчатке мал (~3 %) и присущая недолговечность внешней доли (мембраны) (САЛАТ РОМЭН)).
Данное препятствие было наконец преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и не допускают более хрупким САЛАТОМ РОМЭН хорошо вовлекать ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ») фоторецептора колбочки, относящейся к сетчатке глаза пластине, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981) как ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый подготовленный вид мышей — с уменьшением в нервном лейциновом факторе транскрипции застежки — молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу (генетику) клетки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй — создание EGFP экспрессов в колбочках мыши, которые облегчают/проверяют их идентификацию (Fei и Hughes, 2001).
- Третий — уменьшение количества палочек при transducin α-subunit (gnat1-/), который блокирует фототрансдукцию палочки (Calvert и др., 2000).

- Иллюстрация 16. Ответы в виде вспышек фоторецепторов — колбочек мыши, подготовленных в виде различных генотипов a. Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм, М. колбочек — при вспышках с 510 нм — b. Сравнение средних ответов — вспышки колбочек на вспышки (сигнала) с 361 нм дикого типа S-колбочек, gnat1-/- Булочки, Nrl/-колбочки, и палочки, зарегистрированные под тем же самым «РТОМ» условии. Каждый след — ответ фоторецепторов измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) с разрешением из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, требуется фоновый свет, чтобы подавить ответ палочки так, чтобы ответ колбочки мог быть изолирован. В результате ответ колбочки был немного приспособлен светом, поэтому немного более быстр и меньший для данной интенсивности испытательной вспышки, чем это от gnat1-/- или Nrl-/-кобочек. Когда этот фактор учитывался, легкие свойства ответа колбочек мыши, зарегистрированных от трех mouselines, очень подобны и как ожидается это относится к колбочкам млекопитающих (иллюстрация 16, Стол 3) (Никонов и др., 2006). Видно, ЧТО среди этих особенностей — то, что колбочки мыши намного более терпимы, чем палочки мыши к обесцвеченному пигменту. Темный поток восстанавливается существенно в обоих колбочках типа S-и M. после сильных вспышек (воздействующих на мембрану сигналов), которые отбеливают существенную фракцию фотопигмента. Однако, одно обнаруженное удивление состоит в том, что инактивация пигмента М. более задерживает ответ фоторецептора, чем пигмента S в отсутствии GRK1, предлагая существование GRK1-независимого механизма инактивации для пигмента S. Т.о. Nrl-/-колбочки отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/-колбочки выражают намного более высокий процент содержания фотопигмента S-opsin (синий цвет). Таким образом, трансгенные мыши, выражающие EGFP в их колбочках, и gnat1-/-мыши лучше, чем Nrl-/-мыши для того, чтобы изучать физиологию колбочек.

- Таблица 3. Динамика и параметры чувствительности палочек и кодбочек мыши 1.
Выводы[править | править код]
Согласно приведенным данных исследований Фототрансдукции в палочках и колбочках следует:
- В связи с большими достижения в понимании фототрансдукции палочки, с накопившимся большим количесвом фундаментальных исследований, начиная с введения электрода всасывания, позволяющего производить запись техники при экспериментах в конце 1970-ых (Baylor и др., 1979a), планируемых генных методов 2000-х годов. Фоторецепторы человека, земноводных млекопитающихся (включая примата), могут быть использованы для исследоаний этим методом. Бычья сетчатка была любимой при подготовке к тому, чтобы изучить фототрансдукцию биохимиками из-за изобилия доступной ткани, но мышь стала более популярной моделью животных для исследования, т .к. в прошлом десятилетии добавились более глубокие методы исследований как планируемые методы генных технологий. См. Таблица 1, рис. 2,3.
- Так уже можно увидеть на иллюстрации 16 в сетчатках (в фокальной поверхности) позвоночных животных (мыши, быки) содержатся фоторецепторы палочки и колбочки.
а) — видны полученные кривые ответов колбочек S,M. (синих, зелёных) b) — видны полученные кривые ответов колбочек S,M.,L (синих, зелёных, красноватых) и палочек без цвета.
- В таблице 3 приведены параметры колбочек S,M.(синих, зелёных) и палочек, и характеристики источника фотонного пучка — луча излучателя, воздействующего на фоторецепторы сетчатки.
Откуда, восприятие света и цвета исследовалось на живых клетках, с применением флюоресцентной микроскопии на рецепторном уровне — в сетчатке глаза позвоночных животных. Главнейший механизм восприятия света как фототрансдукция с участием меняющихся фотопигментов возможно было исследовать даже с применением генных методов, вводя различные варианты генетических кодов строения клеток, например, мембраны при котором палочки/колбочки обучаются воспринимать свет по заданной программе. При этом однозначно доказано, что палочки воспринимают слабые лучи света (безцветные-серые), колбочки воспринимают спктральные, цветные (хроматические) лучи света. При этом колбочки делятся на колбочки-S(синие), колбочки-M.(зелёные), колбочки-L(красные).
Также доказано и показано, что появилась возможность уже не гипотетически (как, например, на базе нелинейной теории зрения С.Ременко заниматься исследованиями клеток зрительной системы на основе заменителей самих живых клеток — заменяя глаз, сетчатку, колбочки и палочки фототранзисторами, светофильтрами, колориметрами). Сейчас учёные биофизики, биохимики в содружестве с физиками, учёными и представителями точного оптико-механического производства в своих исследованиях на живых клетках уже на генетическом уровне далеко ушли вперёд. Все новейшие достижения последних десятилетий учёных разных континентов подтверждают и развивают ранее полученные данные, начиная с использований различных анатомических методов. Среди которых — определенная нервная окраска, названная в честь известного раннего итальянского neuroanatomist, Камило Голджи (1885), кто жил в конце прошлого столетия. (Этот красящий метод использовался наиболее экстенсивно и с экстраординарным успехом большим испанским анатомом Рамоном y Cajal (1892). Данный метод и сейчас актуален. Например, флюоресцентная микроскопия на наноуровне).
Главный вывод[править | править код]
Общепризнанный принцип (трихроматизма) — основа теории трёхкомпонентного цветного зрения доказан и принят во всём мире!
Следует заметить, что главный вывод нелинейной теории зрения С.Ременко, что в цветном зрении, в восприятии света и цвета участвуют блок палочка+колбочка — не подтверждается последними приведенным данными отчётов исследований ведущих институтов и лабораторий, отчётов отдельных видных учёных в области зрительной системы. Поэтому, к сожалению, труды советского учёного С.Ременко потеряли актуальность и не находят признания в настоящее время в мире.
См. также[править | править код]
- Теория трёхкомпонентного цветного зрения (версия Миг)
- Опсины (версия Миг)
- Ретиномоторная реакция фоторецепторов (версия Миг)
- Биохимия зрительного восприятия (версия Миг)
Примечания[править | править код]
- ↑ а б в г д е ё ж з Yingbin Fu. ": Phototransduction and Photoreceptor Synaptic Pathways". Webvision. Retrieved 28 июня 2014. Check date values in:
|accessdate=(help) - ↑ http://en.wikipedia.org/wiki/Photoreceptor_cell
- ↑ http://humbio.ru/humbio/ssb/001181d1.htm