Белок и передача зрительных биосигналов
Данная статья отражает видение функционирования принципа цветовосприятия только с точки зрения отдельного пользователя - Миг (сама статья, орфография и стилистика автора сохранены).

Белок в механизме передачи парвичного зрительного сигнала (например, молекулы родопсина) — или механизм фототрансдукции — преобразование и передача первичного светового сигнала (например, не цветового)) это обеспечение, преобразование и усиление первичного светового сигнала почти в миллион раз в клетке фоторецептора, например, палочки.
Введение[править | править код]

Бесцветным, сумеречным зрением люди обязаны зрительным клеткам — фоторецепторам палочкам. Их абсолютную светочувствительность в главным образом определяет рецепторный белок как разновидность фотопигментов опсинов — род-опсин. Молекула родопсина —отправная точка светового сигнала в организме. Под действием света молекула родопсина претерпевает изменения: из розовой она становится желтой . В процессе обесцвечивания рождается нервный фоторецепторный биосигнал. Достигая синаптического окончания палочки, он передает эстафету медиатору — химическому передатчику сигнала. Медиатор пересекает синаптическую щель и взаимодействует с рецепторным белком, встроенным в мембрану рядом расположенной нервной клетки сетчатки. В результате в нервной клетке возникает электрический сигнал. Таким образом химический и электрический сигналы, сменяя друг друга, устремляются по нервным путям к зрительному центру в коре больших полушарий головного мозга. В мозгу и формируются наши собственные зрительные образы. (Подробнее см. ниже).
Образование и передача биосигнала[править | править код]

Квант света поглощается хромофорной группой молекулы
родопсина «Р» – 11-цис ретиналем и изомеризует её в полностью-транс форму. Данная реакция происходит менее, чем за 200 фемтосекунд. Это первая и единственная фотохимическая реакция в зрении. Цис-транс переход ретиналя вызывает, в свою очередь, конформационную перестройку белковой части молекулы (опсина): сначала ближайшего к хромофору окружения, а затем и всей белковой части. Вследствие этого родопсин приобретает способность к взаимодействию со следующим белком в цепи процессов фототрансдукции – G-белком (в зрительной клетке он называется трансдуцином (Т). Активированный трансдуцин, в свою очередь, активирует следующий белок – фермент фосфодиэстеразу (ФДЭ). Этот фермент с высокой скоростью гидролизует низкомолекулярный внутриклеточный передатчик – циклический гуанозинмонофосфат (цГМФ). Падение в цитоплазме наружного сегмента клетки фоторецептора концентрации свободного цГМФ приводит к гиперполяризации клеточной мембраны. Этот электрический потенциал, собственно, и представляет собой фоторецепторный сигнал, который передается в первом синапсе сетчатки следующим нервным клеткам – биполярным и горизонтальным. Таким образом, цепочка процессов родопсин – трансдуцин – фос- фодиэстераза представляет собой каскад ферментативных реакций, обеспечивающих трансформацию, усиление светового сигнала в 105–106 раз.
Активация родопсина в ходе его фотолиза является первым этапом каскада фототрансдукции. Активированным фотопродуктом родопсина является метародопсин II, который и активирует G-белок зрительной клетки, т.н. трансдуцин. Фотолиз и передача первичного сигнала в системе клеток фоторецепторов сетчатки глаза по нервным клеткам биполярным и горизонтальным напоминает передачу света в волноводах, но с тем отличием, что сигнал трансфрмируерся c увеличением в сотни раз, при этом главное при фокусировании предметных точек на фркальную поверхность сетчатки, чтобы фокусировка происходила в зоне ганглиозных клеток фоторецепторов ipRGC с величиной кружков нерезкости диаметром 7-9мкм (острота зрения=1-0,8), где происходит первая встреча с точками первичного оптического изображения (не цветное).
Схема процесса фототрансдукции[править | править код]
- На рис.1:
А) Показаны один фоторецепторный диск в наружном сегменте палочки и в нем основные белки – участники процесса трансдукции: Р – молекула родопсина, Т – молекула трансдуцина или ГТФ-связывающего белка, ФДЭ – молекула фермента фосфодиэстеразы. В цитоплазме наружного сегмента показан фермент гуанилатциклаза – ГЦ. В плазматической (клеточной) мембране палочки показан ионный канал в темновом состоянии.
Через отрытый ионный канал внутрь клетки по градиенту концентрации поступают ионы натрия и кальция. Вследствие этого на плазматической мембране поддерживается темновой электрический потенциал, порядка 40 милливольт. При поглощении кванта света молекула родопсина изменяется, приобретает способность взаимодействовать с трансдуцином и активировать его. В свою очередь, активированный трансдуцин активирует фермент фосфодиэстеразу, которая начинает с высокой скоростью разрушать (гидролизовать) циклический гуанозинмонофосфат – цГМФ. В результате концентрация цГМФ в цитоплазме падает.
Как следствие, связанные в темноте с ионным каналом молекулы цГМФ от него «отваливаются», и свободный от них ионный канал переходит в закрытое состояние (блокируются). Поэтому ионы натрия и кальция перестают поступать в цитоплазму, и электрический потенциал на плазматической мембране наружного сегмента повышается, то есть мембрана гиперполяризуется (потенциал на ней становится равным примерно 70 милливольтам). Этот гиперполяризационный потенциал и является тем электрическим сигналом фоторецепторной клетки, который передается через синапс следующим нервным клеткам сетчатки.
В восстановлении исходного темнового состояния зрительной клетки ключевым событием является активация фермента гуанилатциклазы (ГЦ), который вновь синтезирует цГМФ из ГТФ, восстанавливая его концентарцию в цитоплазме наружного сегмента.
Б) Цепочка родопсин— трансдуцин – фосфодиэстераза представляет собой усилительный каскад ферментативных реакций, обеспечивающих усиление (размножение) первичного светового сигнала в 105 – 106 раз. Одна обесцвеченная молекула родопсина активирует около 500 молекул трансдуцина, трансдуцин активирует фосфодиэстеразу в отношении 1:1, и активированная фосфодиэстераза гидролизует до 1000 молекул цГМФ.
Регенерации пигметов фоторецепторов, например, родопсина[править | править код]
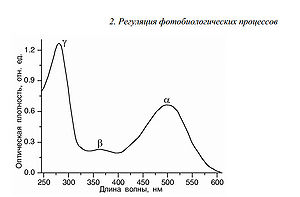

Один из фотопигментов фоторецепторов колбочек, палочек, ipRGC опсинов — родопсин за 40–45 пикосекунд переходит в следующий продукт – батородопсин (см. рис.4). На данной стадии происходят лишь небольшие структурные изменения в ближайшем белковом окружении ретиналя. Образование батородопсина сопровождается стабилизацией значительной части энергии поглощенного кванта света, которая затем тратится на последующие конформационные (структурные) перестройки всей белковой
части молекулы родопсина. Батородопсин после этого в течение нескольких десятков наносекунд переходит в следующий продукт – люмиродопсин. На данной и последующих стадиях в белке происходят существенные конформационные изменения. Люмиродопсин превращается далее в метародопсин I, который наконец переходит в метародопсин II. Максимум спектра поглощения метародопсина II находится при длине волны 380нм, т.е. в зоне УФ-области спектра, хотя его довольно широкий спектр поглощения захватывает и синюю область видимого спектра. Метародопсин II и представляет собой тот промежуточный, долгоживущий продукт фотопревращения родопсина, который приобретает способность к взаимодействию с G-белком (транс-дуцином). Процесс фотопревращения (фотолиза) родопсина завершается разрывом ковалентной химической связи теперь уже полностью-трансретиналя с белком. Таким образом, ретиналь освобождается из белка и оказывается в фосфолипидном окружении мембраны фоторецептора. Ретиналь быстро должен быть удален из мембраны, ибо в противном случае он может стать источником опасности в начале для зрительной клетки, а затем и для клеток пигментного эпителия. Зрительный цикл обеспечивает эффективное удаление полностью-транс ретиналя из мембраны фоторецептора с тем, чтобы затем снова вернуть его в эту мембрану, но уже в 11-цис изомерной форме (рис. 5). Только этот изомер обладает способностью «войти» в молекулу , как ключ в замок, в хромофорный центр («хромофорный карман») белковой части молекулы (опсина) и вновь образовать ковалентную химическую связь с 296-м лизиновым аминокислотным остатком в его седьмой α-спирали.
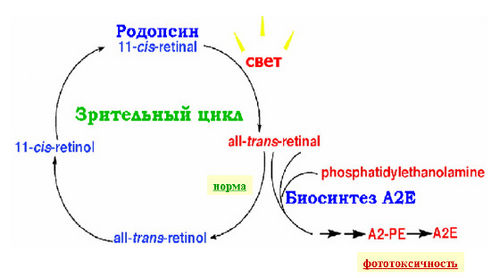
Таков путь регенерации родопсина (схематичный) (см. рис.5) или возвращения его в исходное темновое состояние с максимумом оптического поглощения при 500 нм (точнее 498нм). Регенерация родопсина – одно из ключевых событий в процессе темновой адаптации сетчатки.
Общение нервных клеток[править | править код]
Таким образом, фоторецепторный сигнал, родившийся в результате перестройки молекулы родопсина, распространяется по наружной мембране палочки (колбочки) и достигает ее синаптического окончания. Здесь, в мельчайших пузырьках находится своеобразный химический носитель и передатчик биосигнала предметной точки — медиатор. Он-то и понесет сообщение следующей нервной клетке сетчатки, в мембрану которой встроен специфический рецепторный белок (со своим замком), воспринимающий данный медиатор (с ключом). В результате их взаимодействия совершается трансформация химического сигнала в электрический (при обесцвечивании, разрушении системы). Чередуясь, цепочка сигналов (химический — электрический — химический и т. д.) достигает зрительного центра, и мы видим окружающие предметы.
Такой механизм передачи сигналов (информации) характерен не только для нервных клеток зрительной системы. Аналогичным способом общаются между собой нейроны, нервные и мышечные, нервные и железистые клетки и т. д.
Само общение происходит в месте контакта этих клеток (щелях) — в синапсах. Механизм синаптической передачи сигналов в принципе всюду одинаковый. Под воздействием приходящего электрического (нервного) импульса в синаптическую щель выделяется химическое вещество — медиатор. Пересекая щель, медиатор доходит до постсинаптической мембраны следующей клетки и (вот здесь находится ключевое событие в механизме синаптической передачи сигнала!!!) взаимодействует с встроенным в нее рецепторным белком.
В зависимости от природы клеток в роли медиаторов выступают различные химические вещества: ацетилхолин, норадреналин, глицин, серотонин и другие. И для каждого медиатора существует свой рецепторный белок, воспринимающий его специфическим образом. Например, химическим передатчиком в нервно-мышечном синапсе работает ацетилхолин, а белком-рецептором, соответственно, холинорецептор. Этот рецепторный белок в значительной мере помог исследователям понять механизм преобразования в синапсе химического (ацетилхолинового) сигнала в электрический.
«Охота» за холинорецептором началась в конце сороковых годов нашего века. Именно охота, потому что выделить этот белок в пробирку не удавалось долгое время. И вот почему. Зрительный пигмент родопсин имеет розовую окраску. Поэтому хотя получать его из палочек тоже непросто, но уж если получили, то можно быть уверенным, что в пробирке именно он — родопсин. Холинорецептор же, как и многие другие белки, бесцветный и «особых примет» не имеет. Значит, его надо каким-то образом пометить. Но каким?
Поиски надежной метки растянулись на годы. Много сил отдали этой проблеме советские и зарубежные ученые. «Лед тронулся» в 1970 году: почти одновременно в нескольких лабораториях мира независимо друг от друга исследователи нашли «метку». Ею стали радиоактивные молекулы нейротоксинов, выделенные из яда самых ядовитых змей. Эти нейротоксины оказались тем крючком, на который удалось наконец зацепить холинорецептор и вытащить его из постсинаптической мембраны. После отщепления нейротоксина холинорецептор восстанавливает свою способность функционировать, и его можно использовать для эксперимента.
О последних достижениях в изучении холинорецептора говорилось на V Международном биофизическом конгрессе, который проходил в Копенгагене в августе 1975 года. Из докладов специалистов явствовало, что в институтах и лабораториях мира идет неустанный научный поиск, накапливаются все новые и новые сведения о рецепторных белках. В частности, французским исследователям удалось не только выделить в пробирку весьма чистый холинорецепторный белок, но и встроить его затем в искусственную мембрану. Эта удобная экспериментальная модель мембраны нервной клетки позволит детально проследить за теми перестройками, которые происходят с рецепторным белком при его взаимодействии с ацетилхо-лином.
Чем же объяснить столь пристальное внимание ученых к этому и другим рецепторным белкам?
Рецепторный белок — это тот незаменимый «винтик», без которого не может работать сложнейшая сигнальная система нашего организма. Например, если в палочках сетчатки содержится недостаточно родопсина, светочувствительность глаза снижается: ухудшается зрение. Изучить строение и функции рецепторных белков — значит ответить на многие вопросы (например, выделить пигменты опсинов колбочки-S и др.), а также вопросы, стоящие сегодня перед теоретической и практической медициной. Учёные, исследователи надеются, что дальнейшее проникновение в глубинные механизмы деятельности рецепторных белков поможет вскрыть первопричины многих заболеваний нервной, эндокринной и других систем организма, создать новые лекарственные препараты.
- Вот почему ученые разных специальностей: физиологи, биохимики, биофизики—объединили свои усилия для изучения механизма восприятия, преобразования и передачи сигналов в организме. Цель их работы—познать природу основных жизненных процессов, познать человека на благо человека. М. А. ОСТРОВСКИЙ, доктор биологических наук [7]
См. также[править | править код]
Примечания[править | править код]
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://commons.wikimedia.org/w/index.php?title=Category:Proteins&uselang=ru&filefrom=Structures%0AProtein+TNKS2+PDB+3KR7.png
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf
- ↑ http://bibliotekar.ru/456/6.htm
- перенаправление шаблон:цвета радуги
| Цвета и оттенки | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 |
|  | |||||||||||||||||||||||||||||||||||
| ∘ ∘ ∘ | |||||||||||||||||||||||||||||||||||||