Участник:Миг/Родопсин

Родопси́н (от др.-греч. ρόδον — роза и др.-греч. όπσις — зрение; иногда в качестве синонима используют устаревшее название — зри́тельный пу́рпур) — основной зрительный пигмент. Содержится в виде модификаций в палочках, колбочкахсетчатки глаза морских безпозвоночных, рыб, почти всех наземных позвоночных и человека. Относится к сложным белкам хромопротеинам. Модификации белка, свойственные различным биологическим видам, могут существенно различаться по структуре и молекулярной массе.[2]
Структура молекулы родопсинов[править | править код]
Родопсины микроорганизмов[править | править код]
Родопсины млекопитающих[править | править код]
Функции родопсина[править | править код]
Под действием света зрительный пигмент изменяется и один из промежуточных продуктов его превращения непосредственно ответствен за возникновение зрительного возбуждения. Зрительные пигменты, содержащиеся в наружном сегменте фоторецепторной клетки, представляют собой сложные окрашенные белки (хромопротеиды). Та их часть, которая поглощает видимый свет, и называется хромофором. Это химическое соединение — альдегид витамина А, или ретиналь. Белок зрительных пигментов, с которыми связан ретиналь, называется опсином.
При поглощении кванта света хромофорная группа белка (11-цис-ретиналь) изомеризуется в транс-форму. Возбуждение зрительного нерва происходит при фотохимическом превращении родопсина, и изменениии ионного транспорта в фоторецепторе. Впоследствии родопсин восстанавливается (регенерирует) в результате синтеза 11-цис-ретиналя и опсина или в процессе синтеза новых дисков наружного слоя сетчатки.
Родопсин относится к суперсемейству трансмембранных рецепторов GPCR (рецепторов, связанных с G-белками). При поглощении света конформация белковой части родопсина меняется, и он активирует G-белок трансдуцин, который активирует фермент цГМФ-фосфодиэстеразу. В результате активации этого фермента в клетке падает концентрация цГМФ и закрываются цГМФ-зависимые натриевые каналы. Так как ионы натрия постоянно выкачиваются из клетки АТФ-азой, концентрация ионов натрия внутри клетки падает, что вызывает её гиперполяризацию. В результате фоторецептор выделяет меньше тормозного медиатора глутамата, и в биполярной нервной клетке, которая «растормаживается», возникают нервные импульсы.
Спектр поглощения родопсина[править | править код]

Специфический спектр поглощения зрительного пигмента определяется как свойствами хромофора и опсина, так и характером химической связи между ними (подробнее об этом см. обзор: [3]). Этот спектр имеет два максимума — один в ультрафиолетовой области (278 нм.), обусловленный опсином, и другой — в видимой области (около 500 нм.), - поглощение хромофора рис. 1. Превращение при действии света зрительного пигмента до конечного стабильного продукта состоит из ряда очень быстрых промежуточных стадий. Исследуя спектры поглощения промежуточных продуктов в экстрактах родопсина при низких температурах, при которых эти продукты стабильны, удалось подробно описать весь процесс обесцвечивания зрительного пигмента [4].
На Рис.1, кривая 1, паказан спектр поглощения родопсина, содержащий три основные полосы:
- α — (500 нм),
- β — (350 нм),
- γ — (280 нм).
Полосы α — (500 нм) и β — (350 нм) относятся к области поглощения хромоформной группы. Полоса γ — (280 нм) — относится к группе поглощения ароматических аминокислот белка — триптофана, тирозина и фенилаланина. Так α-полоса в спектре поглощения родопсина расположена на графике кривой палочкового сумеречного видения (зрения) с предельной величиной в зоне лучей сине-зелёной области спектра (т.е. 500нм). Это благодаря высокой фоточувствительности родопсина (ответная реакции выхода сигнала происходит при воздействии квантового фотосигнала величиной в 0,67).[5]
На Рис. 1. показаны спектры поглощения родопсина лягушки Rana temporaria в дигитониновом экстракте. Видны два максимума поглощения в видимой (500 нм.) и ультрафиолетовой (280 нм.) области. График 1 — родопсин (восстановленный пигмент); 2 — индикатор жёлтый (обесцвеченный пигмент). По оси абсцисс — длина волны (λ); по оси ординат — оптическая плотность (D).
В живом глазу наряду с разложением зрительного пигмента, естественно, постоянно идёт процесс его регенерации (ресинтеза). При темновой адаптации этот процесс заканчивается только тогда, когда весь свободный опсин соединился с ретиналем. [6]
Дневное и ночное зрение[править | править код]
Из спектров поглощения родопсина видно, что восстановленный родопсин (при слабом «сумеречном» освещении) отвечает за ночное зрение, а при дневном «цветовом зрении» (ярком освещении) разлагается и максимум его чувствительности смещается в синюю область. Это наглядно показывает известный Эффект Пуркинье.[7]. При достаточном освещении палочка работает совместно с колбочкой, являясь приёмником синей области спектра. [8]. Полное восстановление родопсина у человека (в темноте или при слабом освещении) занимает около 30 минут; в течении всего этого периода чувствительность нашего «сумеречного зрение» постепенно увеличивается, достигая максимума.
Новый фоторецептор ipRGB сетчатки и родопсин[править | править код]
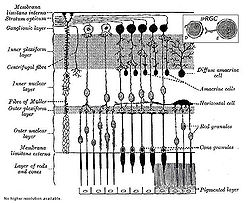
Ячейки ipRGC расположены в сетчатке, в зоне Ganglioniс layer (см.рис.1) и связанны с палочками и колбочками прямой и обратной связью и с мозгом. Они воспринимают фиолетово-синие лучи спектра и передают эти свои сигналы во взаимодействии с мозгом палочкам и колбочкам, непосредственно не участвуя в создании оптических изображений на фокальной поверхности сетчатки (они расположены вне фокальной поверхности сетчатки). Эти фоточувствительные экстерорецепторы (с пигментом меланопсином) сетчатки (460-484нм) выполняют много управляющих функций, в том числе в регулировании величины распада пигментов в палочках и колбочках — радопсина и йодопсина и др.
Это также связано с существованием гипотетического синего пигмента (цианолаба) пока никем не выделенного и не открытого, который совпадет со спектром обесцвеченного разложенного родопсина в палочках, на периферии сетчатки, и со спектром поглощения жёлтого пигмента, в центральной ямке сетчатки.
Сейчас отодвигается на задний план предпаолагаемая связь палочки с колбочкой при сложении двух сигналов (Ременко) с предлагаемой схемой, которая не учитывает работу всех взимосвязанных фоторецепторов сетчатки с изоляцией работы головного мозга, не учитывающей связи ячейки ipRGC с палочками, колбочками. Гипотеза Ременко уступает варианту замеров Уолда [9]. Например, поглощения лучей в диапазоне 430, 540 и 575 нм (синих,зелёных,красных) и современным новым достижениям науки в области строения сетчатки глаза (см. Оппонентная теория цветного зрения).[10].
Родопсин и восприятие цвета[править | править код]
Восприятие цвета начинается с поглощения кванта света молекулой зрительного фотопигмента — родопсина. Расположен он в мембранах дисков наружного сегмента палочек и колбочек сетчатки, а сам сегмент, конструктивно похож на пачку печенья, как сохранивший ножку видоизмененный жгутик: в палочках он имеет форму цилиндра, в колбочках — конуса.
Молекулярной основой фоторецепции является мембранный белок - родопсин, который является хромопротеидом или белок, молекулы которого в качестве небелкового компонента содержат окрашенное соединение (фотопигмент). Его белковый компонент - опсин, который не поглощает свет, и эту способность окраски и не окраски он приобретает при взаимодействии с хромофором - 11-цис-изомером ретиналя (альдегида витамина А - ретинола). Максимумы спектров поглощения родопсина у разных животных могут располагаться как в видимой, так и в ультрафиолетовой части спектра.
Внутриклеточные сигналы рецепторов при трансдукции[править | править код]
Внутриклеточным сигналом, который передаётся на выходное устройство сенсорного рецептора — на синапс, служит изменение разности потенциалов на плазматической мембране клетки. Такое изменение принято называть рецепторным потенциалом, когда у сенсорнго рецептора отсутствует механизм импульсного кодирования, или называется генераторным, если рецепторный сигнал передается к синапсу импульсами.
Так потенциал покоя клетки отрицателен (это в пределах от –40 до –60 мВ). Под воздействием стимула он может или увеличиваться по абсолютной величине, становясь более отрицательным, тогда клетка гиперполяризуется, или уменьшаться, и клетка деполяризуется. На феноменологическом уровне эти события обусловлены изменением проницаемости клеточной мембраны для катионов (натрия, кальция и калия) или анионов (обычно хлора) за счет активации (открывания) или инактивации (закрывания) ионных каналов.
Таким образом, в сенсорной клетке имеется механизм преобразования, при помощи которого активность ионных каналов меняется в зависимости от состояния собственно сенсоров — рецептивных белков. Этот механизм внешний сигнал с языка физического воздействия переводит на универсальный язык, понятный нервной системе. Поскольку рецепторный потенциал — результат сложения индивидуальных токов многих ионных каналов, то говорят об «усилении» входного сигнала. Но такой термин не совсем применим к сенсорным рецепторам, т.к. усиление подразумевает операции с сигналами одной природы: это может быть электрический ток, напряжение или мощность (существуют пневматические усилители, работающие на потоках газа, и т.д.). В сенсорных же рецепторах осуществляется процесс, который преобразует единичное, физическое «микроскопическое» воздействие (квант света, молекула одоранта) на сенсор в макроскопический фоторецепторный потенциал. Отсюда такое преобразование получило общее название как сенсорной трансдукции (т.е. «движение, направленное через, сквозь что-либо», «нахождение за пределами чего-либо», + ducto водить, вести). Частные случаи: фото-, хемо-, механотрансдукция.
- Изучение сенсорной трансдукции стало в наши дни поистине одной из самых горячих точек современной биологии. Оказалось, что в сенсорной трансдукции действуют механизмы, во многом сходные с механизмами восприятия гормональных сигналов и нейромедиаторов. В известном смысле сенсорные рецепторы можно рассматривать как удобную модель для изучения общих принципов внутриклеточной и межклеточной сигнализации, которая играет важнейшую роль в обеспечении целостности многоклеточных организмов.[11]
Дополнительная литература[править | править код]
На русском языке[править | править код]
На английском языке[править | править код]
См. также[править | править код]
Примечания[править | править код]
- ↑ Human Physiology and Mechanisms of Disease by Arthur C. Guyton (1992) p.373
- ↑ http://galactic.org.ua/W-Bronnicov/Teoria-2-2.htm
- ↑ Островский М. А., Федорович С. Е., Голубев И. Н., 1967, Биофизика, 12 : 877.
- ↑ Hubbard R., Bownds D., Yoshizawa T., 1965. Cold Spring Harbor Symp. Biol., 30 : 301.
- ↑ http://library.biophys.msu.ru/PDF/3353.pdf
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Стр. 94 - 101
- ↑ Ричард Филлипс Фейнман. Фейнмановские Лекции по Физике, том № 3, гл. 35 (Цветовое зрение), стр. 157.
- ↑ С. Д. Ременко, «Цвет и зрение», «Картеа Молдовеняскэ», Кишинёв, 1982 г.
- ↑ Wald G. 1964. Science, 144 : 1007.
- ↑ Zaidi FH, Hull JT, Peirson SN, Wulff K, Aeschbach D, Gooley JJ, Brainard GC, Gregory-Evans K, Rizzo JF 3rd, Czeisler CA, Foster RG, Moseley MJ, Lockley SW. Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina. Curr Biol. 2007 Dec 18;17(24):2122-8. http://www.current-biology.com/content/article/abstract?uid=PIIS0960982207022737
- ↑ http://galactic.org.ua/W-Bronnicov/Teoria-2-2.htm
Внешние ссылки[править | править код]
На русском языке[править | править код]
На английском языке[править | править код]
- The Rhodopsin Protein
- Photoisomerization of rhodopsin, animation.
- Rhodopsin and the eye, summary with pictures.
- UMich Orientation of Proteins in Membranes families/superfamily-6 - Calculated spatial positions of rhodopsin-like proteins in membrane
- MeSH Rhodopsin
- перенаправление шаблон:цвета радуги
| [показать]Цвета и оттенки | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 |
|  | |||||||||||||||||||||||||||||||||||
| ∘ ∘ ∘ | |||||||||||||||||||||||||||||||||||||