Глутаматные рецепторы в сетчатке у позвоночных (версия Миг)

|
Первоисточник Эта статья является первичным источником части или всей изложенной в ней информации, содержа первоначальные исследования. |
- Статья создана на базе фундаментальных исследований в области зрения. Перевод и комментарии будут корректироваться.--Миг (обсуждение) 16:52, 14 июня 2013 (UTC)

Глутаматные рецепторы в сетчатке позвоночных обеспечивают взаимодействие ряда клеток, использующих в качестве основного медиатора глутамат-ион.
Химическая синаптическая передача позволяет сигналам нерва быть обмененными между клетками, которые электрически изолированы друг от друга. Химический посыльный, или медиатор, обеспечивают способ послать сигнал поперек внеклеточного места, от предсинаптического нейрона до постсинаптической ячейки. Место называют расщелиной и равное примерно больше, чем 10 нм в перпендикулярном сечении (поперёк).
Краткий обзор[править | править код]
Клетки общаются друг с другом электрически, химически через соединения промежутка, используя медиаторы. Химическая синаптическая передача позволяет сигналам нерва быть обмененными между клетками, которые электрически изолированы друг от друга. Химический посыльный, или медиатор, обеспечивают способ послать сигнал поперек внеклеточного места, от предсинаптического нейрона до постсинаптической клетки. Место называют расщелиной и — оно примерно больше чем 10 нм. Медиаторы синтезируются в предсинаптической клетке и находятся в пузырьках в предсинаптических процессах, как у терминала аксона.
Когда предсинаптический нейрон стимулируется, открытые каналы кальция и приток ионов кальция в терминал аксона вызывает каскад событий, приводящих к выпуску (химического посыльного) медиатора. После того, как выпущенный, медиатор распространяется поперек расщелины и связывает с рецепторами на постсинаптической клетке, позволяя сигнал размножиться. Молекулы медиатора могут также связать с предсинаптическими авторецепторами и транспортеры, регулируя последующий выпуск и очищая лишний медиатор в расщелине. Составы, классифицированные как медиаторы имеют несколько особенностей в совместно рассмотренных в Massey, 1990, Erulkar, 1994. Кратко, (1) медиатор синтезирован, сохранен, и выпущен от предсинаптического терминала. (2) Определенные рецепторы медиатора ограничены в постсинаптических клетках, и (3) там существует механизм, чтобы остановить выпуск медиатора и ясные молекулы из расщелины. Общие медиаторы в сетчатке — глутамат, GABA, глицин, допамин, и ацетилхолин. Составы медиатора могут быть маленькими молекулами, типа глутамата и глицина, или больших пептидов, типа вазоактивного кишечного пептида (очень важное лицо). Некоторые составы neuroactive — аминокислоты, которые также имеют метаболические функции в предсинаптической клетке.
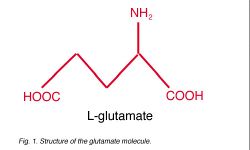
Глутамат (рис. 1), как полагают, является главным возбудительным медиатором в сетчатке. Вообще, глутамат синтезируется от аммония и альфы-ketoglutarate (компонент Цикла Krebs) и используется в синтезе белков, других аминокислот, и даже другие медиаторы (, типа GABA; Stryer, 1988). Хотя глутамат присутствует во всех нейронах, только немногие — glutamatergic, выпуская глутамат как их медиатор. Глутамат Neuroactive сохранен в синаптических пузырьках в предсинаптических терминалах аксона (Fykse и Fonnum, 1996). Глутамат включен в пузырьки глутаматным транспортером, расположенным в везикулярной мембране. Этот транспортер выборочно накапливает глутамат через независимый от натрия, ATP-зависимый процесс (Naito и Ueda, 1983, Tabb и Ueda, 1991, Fykse и Fonnum, 1996), приводя к высокой концентрации глутамата в каждом пузырьке. Глутамат Neuroactive классифицирован как возбудительная аминокислота (EAA), потому что закрепление глутамата в постсинаптических рецепторах типично стимулирует, или деполяризует, постсинаптические клетки или стимулирует[1]
Идентификация гистологическими методами глутаматергических нейронов[править | править код]

Используя immunocytochemical методы, нейроны, содержащие глутамат идентифицированы и помечены глутаматным антителом. В сетчатке, фоторецепторах, биполярных ячейках, и ячейках нервного узла — глутамат иммунореактивен (Ehinger и другие, 1988, Марк и др., 1990, Ван Хаезендонк и Missotten, 1990, Kalloniatis и Флечер, 1993, Ян и Yazulla, 1994, Jojich и Pourcho, 1996) (рис. 2). Некоторые горизонтальные и/или амакринные ячейки могут также показать слабую маркировку глутаматными антителами (Ehinger и др., 1988, Марк и др., 1990, Jojich и Pourcho, 1996; Ян, 1996). Эти нейроны, как полагают, выпускают GABA, не глутамат, как их медиатор (Yazulla, 1986), предлагая, что слабая глутаматная маркировка отражает объединение метаболического глутамата, используемого в синтезе GABA. Это было поддержано следствиями двойного маркирующего исследования, используя антитела и для GABA, и для глутамата: глутаматные-положительные amacrine ячейки также маркируют антителами GABA (Jojich и Pourcho, 1996, Ян, 1996).
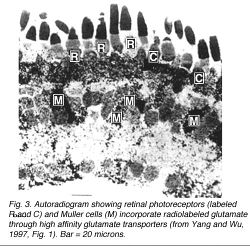
Фоторецепторы, которые содержат глутамат, активно поднимают меченный радиоактивным изотопом глутамат от внеклеточного места, также, как и ячейки Muller (рис. 3) (Марк и Бегство, 1981; Ян и Wu, 1997). Глутамат включен в эти типы ячейки через высокий транспортер глутамата близко расположенного в плазменной мембране. Глутаматные транспортеры поддерживают концентрацию глутамата в пределах синаптической расселины на низких уровнях, предотвращая вызванную глутаматом смерть ячейки (Kanai и др., 1994). Хотя ячейки Muller поднимают глутамат, они не промаркированы глутаматными антителами (Jojich и Pourcho, 1996). Глутамат, включенный в ячейки Muller, быстро ломается внизу в глутамин, который в этом случае экспортируется от глиальных ячеек и входит в окружение нейронов (Голова и Крюк, 1996). Нейроны могут тогда синтезировать глутамат от глутамина (Герц, 1979, Голова и Крюк, 1996).
Таким образом, гистологические методы используются для того, чтобы идентифицировать потенциал глутаматергических нейронов. Маркируя нейроны, содержащие глутамат (через иммуноцитохимию) и нейроны, которые поднимают глутамат (через авторадиографию). Чтобы определять, выпускают ли эти типы клеток фактически глутамат как их медиатор, рецепторы в постсинаптических клетках должны быть исследованы.
Глутаматные рецепторы[править | править код]

После того, как выпущенный от предсинаптического терминала глутамат распространяется поперек расселины, он связывает рецепторы, расположенные на дендритах постсинаптической ячейки (ек). Многократные глутаматные типы рецептора были идентифицированы. Хотя глутамат связывает все глутаматные рецепторы, каждый рецептор характеризуется его чувствительностью к определенным глутаматным аналогам и особенностями выявляемого глутаматом потока. Глутаматные участники действия рецептора и антагонисты структурно подобны глутамату (рис. 4), который позволяет им связывать глутаматные рецепторы. Эти составы являются очень определенными и, даже в неповрежденной ткани могут использоваться в очень низких концентрациях, потому что они бедные основания для глутаматных систем (Tachibana и Кейнко, 1988, Schwartz и Tachibana, 1990).
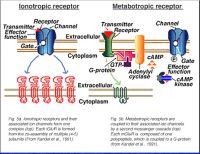
Два класса глутаматных рецепторов (рис. 5) были идентифицированы: (1) ionotropic глутаматные рецепторы, которые непосредственно образуют каналы иона ворот, и (2) metabotropic глутаматные рецепторы, которые могут быть соединены в канале иона или другие клеточные функции через внутриклеточный второй каскад посыльного. Эти типы рецепторов подобны в этом, они оба связывают глутаматное и глутаматное закрепление, что может влиять на проходимость каналов иона. Однако, между этими двумя классами есть несколько различий.
Рецепторы глутамата Ionotropic[править | править код]
(Ionotropic — группа трансмебранного ионного канала белков, которые открыты для прохода ионов натрия, калия, кадьция или хрома через мембрану в ответ на привязку химического посланника нейромедиатора.[2]).
Закрепление глутамата на ionotropic рецепторе непосредственно влияет на деятельность канала иона, потому что рецептор и канал иона формируют один комплекс (рис. 5a). Эти рецепторы добиваются быстрой синаптической передачи между нейронами. Каждый ionotropic глутаматный рецептор, или iGluR, сформированы из собрания индивидуальных подъединиц. Собранные подъединицы могут быть или, возможно, не быть соответственно с различными комбинациями подъединиц, приводящих к каналам с различными особенностями (Keinanen и др., 1990, Verdoorn и др., 1991, Moyner и др., 1992; Nakanishi, 1992, Ozawa и Rossier, 1996).
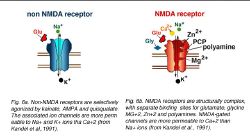
Два типа iGluR (см. рис. 6) были идентифицированы: (1) рецепторы NMDA, которые связывают глутамат и глутаматный аналог N-Methyl-D-Aspartate (NMDA) и (2) non-NMDA рецепторы, которые выборочно образовываются каинат, AMPA, и квисквалата, но не NMDA.
Рецепторы Non-NMDA.

1. Клеточная мембрана
2. Канал, блокируемый магнием Mg2+
3. Сайт блокировки Mg2+
4. Сайт связывания галлюциногенов
5. Сайт связывания цинка Zn2+
6. Сайт связывания агонистов (глутамат) и\или антагонистов (APV)
7. Сайты гликозилирования
8. Сайты связывания протонов
9. Сайты связывания глицина
10. Сайт связывания полиаминов
11. Внеклеточное пространство
12. Внутриклеточное пространство
13. Комплексная (сложная) субъединица
- (NMDA-рецептор (NMDAR; НМДА-рецептор) — ионотропный рецептор глутамата, селективно связывающий N-метил-D-аспартат (NMDA)[1].)
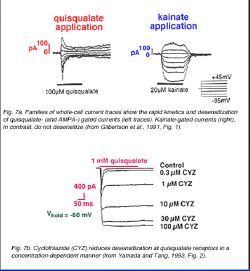
Закрепление глутамата на non-NMDA рецепторе открывает не отборные каналы катиона, более водопроницаемые по отношению к натрию (Na +) и калию (K +) ионы, чем к кальцийю (Ca+2) (Mayer и Westbrook, 1987). Глутаматное закрепление выявляет быстро активизирующийся внутренний поток в мембранных потенциалах, от отрицательных до 0 милливольтам, и потоку направленны наружу в потенциалах, уверенных и равных 0 милливольтам. Kainate, квисквалата, и AMPA (alpha-amino-3-hydroxy-5-methyl-4-изоксазолпропионовая кислота) — определенные участники состязания в этих рецепторах; CNQX (6-cyano-7-нитрохиноксалин-2,3-дион), NBQX (1,2,3,4-тетрагидро-6-нитро-2,3-дион-бензо [f] хиноксалин-7-сульфонамид), и в В сетчатке, non-NMDA рецепторы были идентифицированы на горизонтальных ячейках, не биполярных ячейках, но на амакринных ячейках, и ячейках нервного узла (см. ниже). Регистрация зажима участка (Gilbertson и др., 1991, Zhou и др., 1993, Шиканье и др., 1993, Cohen и Мельник, 1994, Yu и Мельник, 1995) указывает, что AMPA, квисквалата, и/или появление каината может вызвать потоки в этих ячейках. Однако, кинетика потоков закрытого лиганда отличается. AMPA — и квисквалата-выявляемые потоки быстро уменьшают чувствительность; тогда как, каинат закрытых потоков этого не делают (рис. 7a). Десенсибилизация в рецепторах AMPA/квисквалата может быть уменьшена (рис. 7b), добавляя циклотиазид (Yamada и Сильный запах, 1993), который стабилизирует рецептор в активном (или не уменьшенной чувствительности) состоянии (Yamada и Сильный запах, 1993, Kessler и др., 1996).
Каждый non-NMDA рецептор сформирован из собрания нескольких подъединиц (Длинные леса с несколькими крючками и др., 1990, Nakanishi и др., 1990, Nakanishi, 1992). До настоящего времени, семь подъединиц (названный GluR1 через GluR7) были клонированы (Hollmann и др., 1989, Длинные леса с несколькими крючками и др., 1990, Keinanen и др., 1990, Nakanishi и др., 1990, Bettler и др., 1990, 1992, Egebjerg и др., 1991). Выражение клонов подъединицы в ооцитах Xenopus показало, что GluR5, GluR6, и GluR7 (наряду с подединицами KA1 и KA2) собираются, чтобы сформировать kainate (—предпочтение) рецепторы; тогда как, GluR1, GluR2, GluR3, и GluR4 собраны в AMPA (предпочтительно) рецепторы (Nakanishi, 1992
Рецепторы NMDA.
Закрепление глутамата на рецептор NMDA также открывает неотборные каналы катиона, приводя к увеличению проводимости. Однако, высокий канал проводимости, связанный с этими рецепторами более водопроницаем к Ca+2 чем Na +, ионы (Mayer и Westbrook, 1987) и потоки NMDA-gated типично имеют медленнее kinetics чем kainate-и каналы AMPA-gated. Поскольку название предлагает, NMDA — отборный участник состязания в этих рецепторах. ЗНАК составов 801, AP 5 (2-amino-5-phosphonopentanoic кислота), и AP 7 (2-amino-7-phosphoheptanoic кислота) — антагонисты рецептора NMDA.
Рецепторы NMDA структурно сложны, с отдельными обязательными участками для глутамата, глицина, ионы магния (Mg+2), цинковые ионы (Zn+2), и участок признания многоамина (рис. 6b). Есть также антагонист обязательный участок для ОПТРОНА и ЗНАКА 801 (Домик, 1997). Глутамат, глицин, и магний обязательные участки важны для активации рецептора и gating канала иона. Напротив, цинк и участки многоамина не необходимы для активации рецептора, но затрагивают эффективность канала. Цинк блокирует канал в независимой от напряжения манере (Westbrook и Mayer, 1987). Участок многоамина (Выкуп и Stec, 1988, Williams и др., 1994) связывает составы, типа spermine или spermidine, любой potentiating (Ranson и Stec, 1988; Williams и др., 1994) или запрещающий (Williams и др., 1994) деятельность рецептора, в зависимости от комбинации подединиц, формирующих каждый рецептор NMDA (Williams и др., 1994).

До настоящего времени, пять подъединиц (NR1, NR2a, N2b, N2c, и N2d) рецепторов NMDA были клонированы (Moriyoshi и др., 1991, Ikeda и др., 1992, Katsuwada и др., 1992, Meguro и др., 1992, Ishii и др., 1993). Как с non-NMDA рецепторами, подъединицы рецептора NMDA могут собраться как homomers (то есть, пять подединиц NR1; Moyner и др., 1992, Moriyoshi и др., 1992) или heteromers (один NR1 + четыре подединицы NR2; Meguro и др., 1992, Katsuwada и др., 1992, Moyner и др., 1992, Ishii и др., 1993). Однако, все функциональные рецепторы NMDA выражают подъединицу NR1 (Moyner и др., 1992, Nakanishi, 1992, Ishii и др., 1993).
Глутамат, глицин, и Mg+2 обязательные участки вознаграждвют и лиганд-gated и свойства напряжения-gated на рецепторы NMDA. Рецепторы NMDA — лиганд-gated, из-за закрепления глутамата (лиганд) обязано активизируют канал. Кроме того, концентрации микрокоренного зуба глицина должны также присутствовать (рис. 8) (Johnson и Ascher, 1987, Kleckner и Dingledine, 1988). Требование и для глутамата и для глицина делает их cоучастниками соревнования (Kleckner и Dingledine, 1988) в рецепторах NMDA.
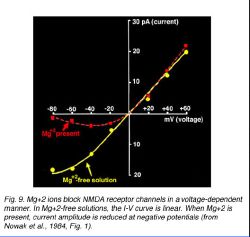
Ионы Mg+2 обеспечивают зависимым напряжением блок каналов NMDA-gated (Nowak и др., 1984). Это может быть замечено в текущем напряжении (I—V) отношения, представленные в рис. 9 (от Nowak и др., 1984).
Кривые I—V, подготовленные от потоков, зарегистрированных в присутствии Mg+2 имеют характерную J-форму (пунктир); тогда как, линейные отношения вычислены в Mg+2-free решениях (твердая линия). В отрицательных мембранных потенциалах, ионы Mg+2 занимают обязательный участок, вызывающий менее текущую течь через канал. Поскольку мембрана деполяризует, блок Mg+2 удален (Nowak и др., 1984).
Клетки сетчатки глаза нервного узла и некоторые amacrine типы клеток выражают функционирование рецепторов NMDA в дополнение к non-NMDA рецепторам (то есть, Massey и Мельнику, 1988, 1990, Mittman и др., 1990, Dixon и Копенгаген 1992, Алмаз и Копенгаген, 1993, Cohen и Мельник, 1994). Потоки, выявляемые через эти различные типы iGluR можно отличить фармакологически. Антагонисты рецептора Non-NMDA блокируют переходный компонент ответа света ячейки нервного узла; тогда как, антагонисты рецептора NMDA блокируют более длительный компонент (Mittman и др., 1990, Алмаз и Копенгаген, 1993, Hensley и др., 1993, Cohen и Мельник, 1994). Эти полученные данные предлагают потоки, выявляемые через cо-ограниченный NMDA, а non-NMDA рецепторы добиваются отличительных вкладов в НА — не легких ответов, наблюдаемых в ячейках нервного узла (то есть, Алмазе и Копенгагене, 1993).
Рецепторы глутамата Metabotropic[править | править код]
(Metabotropic глутаматные рецепторы, или mGluRs, являются типом глутаматного рецептора, которые являются активными посредством косвенного процесса metabotropic. Они — члены группы C семья Соединенных с г с-белком рецепторов, или GPCRs [Bonsi P, Куомо Д, Де Персис К, Centonze D, Г Bernardi, Calabresi P, Pisani (2005). [ «действие Modulatory metabotropic глутаматного рецептора (mGluR) 5 на mGluR1 функционирует в striatal холинергических межнейронах»]. Нейрофармакология 49 Suppl 1: 104‒13. doi:10.1016/j.neuropharm.2005.05.012. PMID 16005029]. Как все глутаматные рецепторы, mGluRs связывают с глутаматом, аминокислота, которая функционирует как возбудительный нейромедиатор.[2])
В отличие от ionotropic рецепторов, которые непосредственно связаны с каналом иона, метаботропные рецепторы соединены с их связанным каналом иона через вторую тропу посыльного. Лиганд (глутаматное) закрепление активизирует Белок г начинает внутриклеточный каскад (Nestler и Duman, 1994). Рецепторы глутамата Metabotropic (mGluRs) не собраны от многократных подъединиц, но собраны с одним многопептидом (рис. 5b). До настоящего времени, восемь mGluRs (mGluR1-mGluR8) были клонированы (Houamed и др., 1991, Masu и др., 1991, Эйб и др., 1992, Tanabe и др., 1992, Nakajima и др., 1993, Saugstad и др., 1994, Duvoisin и др., 1995). Эти рецепторы классифицированы в три группы (я, II, и III) основанные на структурном соответствии, селективности участника состязания, и их связанном втором каскаде посыльного (Стол 1, конец главы) (рассмотренный в Nakanishi, 1994, Knopfel и др., 1995, Булавка и Duvoisin, 1995, Булавка и Bockaert, 1995).
Короче говоря, Группа я mGluRs (mGluR1 и mGluR5) соединена с гидролизом жирных кислот и выпуску кальция от внутренних складов. Quisqualate и сделка-ACPD — Группа я участники действия. Группа II (mGluR2 и mGluR3) и Группа III (mGluRs 4, 6, 7, и 8) рецепторы считаются запрещающими, потому что они соединены к подавленому циклическому синтезу нуклеотида (Булавка и Duvoisin, 1995). L-CCG-1 и сделка-ACPD агонизируют Группа II рецепторов; L-AP4 (также названный APB) выборочно агонизирует Группу III рецепторов. На месте исследования скрещивания показали, что mRNAs при зашифровывании Группы, я, II, и III mGluRs присутствую в сетчатке (см. ниже); однако, за исключением рецептора APB, функция всех этих типов рецептора в сетчатке не была характеризована.
Рецептор APB.
- (6-(2-аминопропил)benzofuran или 1-benzofuran-6-ylpropan-2-Амин (6-APB) — это entactogenic соединение фенилэтиламина и амфетамин классы. Это похожие в структуру Мда но отличие в том, что в 3,4-метилендиоксифенил кольцо система была заменена benzofuran кольцо. 6-APB также ненасыщенные benzofuran производной 6-APDB.[3])
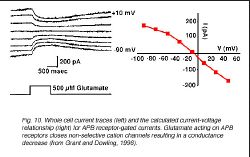
В отличие от non-NMDA и рецепторов NMDA, закрепление глутамата на рецепторе APB выявляет уменьшение проводимости (Резня и Мельник, 1981, Nawy и Копенгаген, 1987, 1990) из-за закрытия cGMP-gated не отборных каналов катиона (Nawy и Jahr, 1990) (рис. 10).
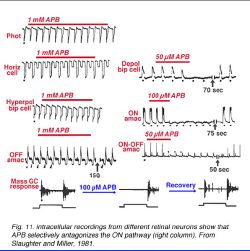
Заявление APB выборочно блокирует НА-ТРОПЕ в сетчатке (рис. 11) (Резня и Мельник, 1981), то есть, НА-БИПОЛЯРНОЙ-ЯЧЕЙКЕ ответы и НА-ОТВЕТАХ в amacrine ячейках (Тэйлор и Wassle, 1995), и ячейки нервного узла (Cohen и Мельник, 1994, Kittila и Massey, 1995, Jin и Brunken, 1996) устранены APB. Экспериментальное свидетельство (Резня и Мельник 1981, Massey и др., 1983) предлагает, что рецептор APB ограничен к НА-БИПОЛЯРНОЙ-ЯЧЕЙКЕ дендритам. Запрещение amacrine и ответов на действие света ячейки нервного узла происходит поэтому, что из-за уменьшения во входе от НА-БИПОЛЯРНЫХ-ЯЧЕЙКАХ происходит не на прямом эффекте у постсинаптических рецепторов.
APB (2-amino-4-phosphobutyric кислота, также названная L-AP4) — отборный участник действия для всей Группы III mGluRs (mGluR4, 6, 7, и 8). Вопрос, который рецептор APB расположен на НА-БИПОЛЯРНОЙ-ЯЧЕЙКЕ дендритах? MGluR4, 7, и 8 проявлений были соблюдены и во внутреннем ядерном слое и в слое клетки нервного узла (Duvoisin и др., 1995, Hartveit и др., 1995) предлагающие, что эти mGluRs связаны с больше, чем одним типом ячейки. Напротив, mGluR6 проявление было ограничено этим INL (Nakajima и др., 1993, Hartveit и др., 1995) и OPL (Nomura и др., 1994), где сома биполярной ячейки и дендриты расположены. Кроме того, НА-ОТВЕТАХ, отмененые в мышах, испытывают недостаток mGluR6 проявления (Masu и др., 1995). Эти мутанты также показывают неправильные b-волны ЭРГА, предлагая запрещение НА-ОТНОСЯЩЕМСЯ-К-СЕТЧАТКЕ-ГЛАЗА тропа на уровне биполярных ячеек (Masu и др., 1995). Взятые вместе, эти полученные данные предлагают, что рецептор APB на НА-БИПОЛЯРНЫХ-ЯЧЕЙКАХ — mGluR6.
Глутаматные транспортеры и подобные транспортеру рецепторы[править | править код]
Глутаматные транспортеры были идентифицированы на фоторецепторах (Марк и Бегство, 1981, Tachibana и Кейнко, 1988, Eliasof и Werblin, 1993) и ячейки Muller (Марк и Бегство, 1981, Ян и Wu, 1997). От глутамата, маркирующего исследования, средняя концентрация глутамата в фоторецепторах, биполярные ячейки, и ячейки нервного узла — 5mM (Марк и др. 1990). Физиологические исследования, используя изолированные ячейки указывают, что только µM уровни глутамата обязан активизировать глутаматные рецепторы (то есть, Aizenman и др., 1988, Zhou и др., 1993, Sasaki и Кейнко, 1996). Таким образом, количество глутамата, выпущённого в синаптическую расселину — несколько порядков величины выше чем концентрация, требуемая активизировать большинство постсинаптических рецепторов. Высокие транспортеры глутамата близости, расположенные на смежных нейронах и окружении глиальных ячеек быстро удаляют глутамат из синаптической расселины, чтобы предотвратить смерть ячейки (Kanai и др., 1994). Пять глутаматных транспортеров, EAAT-1 (или GLAST), EAAT-2 (или GLT-1), EAAT-3 (или EAAC-1), EAAT-4, и EAAT-5, были клонированы (Kanai и Hediger, 1992, Сосны и др., 1992, Fairman и др., 1995, Schultz и Stell, 1996, Arriza и др., 1997, Kanai и др., 1997).
Глутаматные транспортеры фармакологически отличны и от iGluRs и от mGluRs. L-глутамат, L-аспартат, и D-аспартат — основания для транспортеров (Варево и Attwell, 1987, Tachibana и Кейнко, 1988, Eliasof и Werblin, 1993); глутаматные участники состязания рецептора (Варево и Attwell, 1987, Tachibana и Кейнко, 1988, Schwartz и Tachibana, 1990, Eliasof и Werblin, 1993) и антагонисты (Barbour и др., 1991, Eliasof и Werblin, 1993) не. Глутаматная сообразительность может быть блокирована блокаторами транспортера dihydrokainate (DHKA) и DL-threo-beta-hydroxyaspartate (ХА) (Barbour и др., 1991, Eliasof и 1993 Werblin).0

Глутаматные транспортеры включают глутамат в ячейки Muller наряду с cо-транспортом трех Na + ионы (Варево и Attwell, 1987, Barbour и др., 1988) и антипорт одного K + ион (Barbour и др., 1988, Bouvier и др., 1992) и или один О — или один HCO3-ион (Bouvier и др., 1992) (рис. 12). Лишние ионы натрия производят чистый положительный внутренний поток, который ведет транспортер (Варево и Attwell, 1987, Barbour и др., 1988). Более свежие полученные данные указывают, что выявляемый глутаматом поток хлорида также связан с некоторыми транспортерами (Eliasof и Jahr, 1996, Arriza и др., 1997).
Должно быть отмечено, что глутаматные транспортеры, расположенные в плазменной мембране нейронала и глиальных ячеек (обсужденный в этой секции) отличаются от глутаматных транспортеров, расположенных на синаптических пузырьках в пределах предсинаптических терминалов (см. секцию 1). Транспортеры в плазменной мембране транспортируют глутамат в Na ±и зависимой напряжением манере, независимой от хлорида (Варево и Attwell, 1987, Barbour и др., 1988, Kanai и др., 1994). L-глутамат, L-аспартат, и D-аспартат — основания для этих транспортеров (то есть, Варева и Attwell, 1987). Напротив, везикулярный транспортер выборочно концентрирует глутамат в синаптические пузырьки в Na ±независимый, ATP-зависимая манера (Naito и Ueda, 1983, Tabb и Ueda, 1991, Fykse и Fonnum, 1996), который требует хлорида (Tabb и Ueda, 1991, Fykse и Fonnum, 1996).
Глутаматные рецепторы с подобной транспортеру фармакологией были описаны в фоторецепторах (Picaud и др., 1995a, b, Предоставление и Werblin, 1996) и НА-БИПОЛЯРНЫХ-ЯЧЕЙКАХ (Предоставление и 1995 Dowling, 1996). Эти рецепторы соединены к потоку хлорида. Фармакология этих рецепторов подобна описанному для глутаматных транспортеров, поскольку выявляемый глутаматом поток (1) иждивенец на внешний Na +, (2) уменьшен блокаторами транспортера, и (3) нечувствительный к глутаматным участникам состязания и антагонистам. Однако, изменяя внутренний Na + концентрация не изменяет потенциал аннулирования (Picaud и др., 1995b) или амплитуда (Предоставление и Werblin, 1995, Предоставление и Dowling, 1996) выявляемого глутаматом потока, предлагая, что рецептор отличен от глутаматных транспортеров. В терминалах фоторецептора, выявляемый глутаматом поток хлорида может регулировать мембранную потенциальную и последующую деятельность канала закрытого напряжения (то есть, Picaud и др., 1995a). Постсинаптически, этот рецептор, как полагают, добивается изменений проводимости, лежащих в основе входа фоторецептора к НА — биполярные ячейки конуса (Предоставление и Dowling, 1995).
Локализация глутаматного рецептора в сетчатке[править | править код]
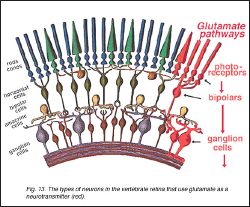
Фоторецептор, биполярный, ячейки нервного узла включают вертикальную тропу трансдукции в сетчатке. Эта тропа смодулирована боковыми входами от горизонтальных ячеек в отдалённой от центра сетчатке и амакринных ячейках в ближайшей сетчатке (рис. 13). Как описано в предыдущих секциях, фоторецептор, биполярный, и ячейки нервного узла показывает глутаматную иммунореактивность. Глутаматные ответы были электрически характеризованы в горизонтальных и биполярных ячейках, которые являются постсинаптическими на фоторецепторы, и в амакринных ячейках и ячейках нервного узла, которые являются постсинаптическими к биполярным ячейкам. Взятый вместе, эти результаты предлагают, что глутамат — медиатор, выпущённый нейронами в вертикальной тропе. Недавний на месте скрещивание и исследования иммуноцитохимической iGluR подединиц, mGluRs, и глутаматных белков транспортера в сетчатке. Эти полученные данные получены в итоге ниже.
Ionotropic глутаматных рецепторов сетчатки[править | править код]
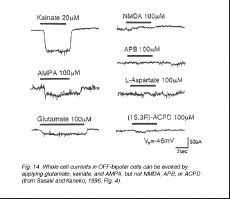

И у высших и более низких позвоночных животные, электрофизиологические методы регистрации идентифицировали ионотропные глутаматные рецепторы на нейронах, включающих вне тропы (Стол 2, конец главы). В отдалённой от центра сетчатке, небиполярные ячейки (рис. 14) (Euler и др., 1996, Sasaki и Кейнко, 1996, Hartveit, 1997) и горизонтальные ячейки (рис. 15) (Ян и Wu, 1991, Zhou и др., 1993, Kriaj и др., 1994) отвечают на каинат, AMPA, и квисквалату, но не NMDA, ни APB. (Однако, рецепторы NMDA были идентифицированы на зубатке, о горизонтальных ячейках (OНDell и Christensen, 1989, Eliasof и Jahr, 1997) и APB-вызванная гиперполяризация паказала в небольшом количестве рыбы горизонтальные ячейки (Nawy и др., 1989, Takahashi и Копенгаген, 1992, Furukawa и др., 1997)).
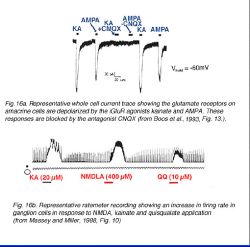
Участники состязания Non-NMDA также стимулируют и амакринные ячейки (рис. 16a) (Massey и Мельника, 1988, Dixon и Копенгаген, 1992, Шиканье и др., 1993) и ячейки нервного узла (рис. 16b) (Mittman и др., 1990, Алмаз и Копенгаген, 1993, Hensley и др., 1993, Cohen и Мельник, 1994, Yu и Мельник, 1995). Ответы ячеек нервного узла на NMDA были прослежены (Massey и Мельник, 1988, 1990, Mittman и др., 1990, Алмаз и Копенгаген, 1993, Cohen и Мельник, 1994); тогда как, ответы NMDA были зарегистрированы только в некоторых типах амакринных ячеек (Massey и Мельник, 1988, Dixon и Копенгаген, 1992, Шиканье и др., 1993 и см. Hartveit и Veruki, 1997).
Совместимые с этими физиологическими данными, антитела к различным non-NMDA подъединицам рецептора дифференцированно маркируют все относящиеся к сетчатке глаза слои (Стол 3, конец главы; Hartveit и др., 1994, Peng и др., 1995, Hughes, 1997, Pourcho и др., 1997), и mRNAs зашифровывание различного non-NMDA iGluR подъединицы подобно выражены (Hughes и др., 1992, Hamassaki-Britto и др., 1993, Brandstatter и др., 1994). Напротив, mRNAs кодирующий подъединицы NMDA выражены преобладающе в ближайшей сетчатке, где расположены amacrine и ячейки нервного узла (INL, IPL, GCL; Стол 3) (Brandstatter и др., 1994, Hartveit и др., 1994), хотя mRNA зашифровывание подъединицы NR2a (Hartveit и др., 1994) было соблюдено в OPL и в антителах NR2d (Wenzel и др., 1997) и также подъединицы NR1 (Hughes, 1997) биполярных ячеек прута.
Нейроны сетчатки в виде метаботропных глутаматных рецепторов[править | править код]
Все метаботропные глутаматные рецепторы, кроме mGluR3, были идентифицированы в сетчатке через окрашивание антитела (Peng и др., 1995, Brandstatter и др., 1996, Koulen и др., 1997, Pourcho и др., 1997) или в местх скрещивания (Nakajima и др., 1993, Duvoisin и др., 1995, Hartveit и др., 1995). MGluRs дифференцированно выражены всюду по сетчатке, определенно во внешнем сетевидном слое, внутреннем ядерном слое, внутреннем сетевидном слое и слое ячейки нервного узла (Стол 4, конец главы). Хотя различные образцы mGluR выражения были соблюдены в сетчатке, но только рецептор APB на НА-БИПОЛЯРНЫХ-ЯЧЕЙКАХ был физиологически исследован.
Нейроны сетчатки как глутаматные транспортеры[править | править код]
Глутаматные транспортеры GLAST, EAAC1, и GLT-1have, идентифицированные в сетчатке (Стол 5, конец главы). GLAST (транспортер L-glutamate/L-aspartate) иммунореактивности найден во всех относящихся к сетчатке глаза слоях (Otori и др. 1994), но не в ткани нейронала. GLAST ограничен на уровыне мембраны ячейки Muller (Otori и др. 1994, Derouiche и Rauen, 1995, Rauen и др., 1996, Lehre и др., 1997). Напротив, EAAC-1 (возбудительный курьер аминокислоты 1) антитела не маркируют ячейки Muller или фоторецепторы. Иммунореактивность EAAC-1 соблюдена в нервном узле и амакринных ячейках в цыпленке, крысе, серебряном карасе, и сетчатках черепахи. Кроме того, биполярные ячейки, уверенные помеченные антителом EAAC-1 в более низких позвоночных животных и иммунопозитивных горизонтальных ячейках были соблюдены в крысе (Schultz и Stell, 1996). GLT-1 (глутаматный транспортер 1) белки биполярных ячеек были идентифицированы в обезьяне (Grunert и др., 1994), крысе (Rauen и др., 1996), и кролике (Massey и др., 1997). Кроме того, несколько амакринных ячеек были слабо помечены антителом GLT-1 в крысе (Rauen и др., 1996), как были терминалы фоторецептора в кролике (Massey и др., 1997).
Таким образом, работа экстерорецепторов сетчатки колбочек, палочек, ганглиозных клеток ipRGC при получении и проведении сигнала предметной точки, его выделения в виде основных лучей RGB в процессе оппонентного отбора на уровне сетчаткм, отсылки по зрителным нервам в мозг не мыслима без работы глутаматных рецепторов.
Резюме и заключения[править | править код]

Гистологические исследования предсинаптических нейронов и физиологической регистрации от постсинаптических клеток предлагают фоторецептор биполярный, и ячейки нервного узла, которые выпускают глутамат как их медиатор. Многократные глутаматные типы рецептора присутствуют в сетчатке. Эти рецепторы фармакологически отличны и дифференцированно распределены. IGluRs непосредственно каналы иона ворот и добиваются быстрой синаптической передачи или через каинат/AMPA или через рецепторы NMDA. Закрепление глутамата на iGluRs открывает каналы катиона, деполяризуя постсинаптическую мембрану ячейки. Нейроны в пределах вне тропы (горизонтальные ячейки, небиполярные ячейки, amacrine ячейки, и ячейки нервного узла) выражают функциональный iGluRs. MGluRs соединены с Белкамми г. Закрепление глутамата на mGluRs может иметь разнообразие эффектов в зависимости от второго каскада посыльного, на который соединен рецептор. Рецептор APB, найденный на НА-БИПОЛЯРНОЙ-ЯЧЕЙКЕ дендритах, соединен для синтеза c GMP. В этих рецепторах, глутамат уменьшает c GMP формирование, приводящее к закрытию каналов иона. Глутаматные транспортеры, найденные на глиальном и ячейке фоторецептора, также присутствуют в glutamatergic синапсах (рис. 17). Транспортеры удаляют лишний глутамат из синаптической расселины, чтобы предотвратить нейротоксичность. Таким образом, постсинаптические ответы на глутамат определены распределением рецепторов и транспортером в glutamatergic синапсах, которые, в сетчатке, определяют механизмы проводимости, лежащие в основе визуальной обработки информации в пределах НА — и вне троп.
Откуда, работа экстерорецепторов сетчатки колбочек, палочек, ганглиозных клеток ipRGC при получении и проведении сигнала предметной точки, его выделения в виде основных лучей КЗС в процессе оппонентного отбора на уровне сетчаткм, отсылки по зрителным нервам в мозг не мыслима без работы глутаматных рецепторов (Биполярных и ганглтозных клеток сетчатки. (См. Рис. 13)).
См. также[править | править код]
- Теория трёхкомпонентного цветного зрения (версия Миг)
- Синапсы и связи фоторецепторов в нейронных сетях сетчатки (версия Миг)