Опсины (версия Миг)
Опсины (G-белки фотосинтеза и зрительные фотопигменты) — группа рецепторных белков семейства ретинолидов с молекулярной массой 35-55 кДа, связанных с мембраной G-протеинов (G protein-coupled). Обнаружены в мембране галобактерий, светочувствительных фоторецепторных клетках беспозвоночных и позвоночных животных (сетчатка (версия Миг)), фотосинтезирующих организмах, в светочувствительном пигменте меланофоров кожи земноводных, радужке лягушки и т.д.
Опсины играют важную роль в зрительном, обонятельном и вомероназальном восприятии у животных, а также в формировании циркадных ритмов.
Пять групп опсинов вовлечены в зрительный процесс, обеспечивая трансформацию сигнала от фотона — к электрохимическому нервному импульсу (первый шаг в процессе зрительной трансдукции). В сетчатке млекопитающих найдены и другие опсины, например меланопсин (версия Миг) (пигмент клеток-меланофоров). В форме бактериородопсина опсины обнаружены в бактериях (эволюция опсинов).
Общие сведения[править | править код]
Опсины — «змеевидные» белки, связаные с G-белками, имеют сходную, семидоменную структуру. Они выделены и исследованы у многих позвоночных и беспозвоночных животных. Опсины принадлежат к большому надсемейству эволюционно родственных белков, и содержат зрительные, обонятельные рецепторные белки, а также большое количество синаптических рецепторных молекул.
Пять групп опсинов принимают участие в процессе зрительного восприятия, превращении света в электрохимический сигнал, и являются первым этапом в каскаде зрительной фототрансдукции. В целом эти опсины можно разделить на две группы:
- Род-опсины (от Rod — палочка);
- Кон-опсины (от Con — колбочка);[1]
Эволюция опсинов и фототрансдукция[править | править код]
Опсины- универсальные молекулы фоторецепторов всех визуальных систем в животном мире. Они могут изменять свою конформацию от состояния покоя до состояния сигнализации при поглощении света, что активирует белок G, что приводит к сигнальному каскаду, который вызывает физиологические реакции. Этот процесс захвата фотона и превращения его в физиологический ответ известен как фототрансдукция. Недавние методы клонирования выявили богатый и разнообразный характер этих молекул, обнаруженных в организмах от медузы до людей, функционирующих в визуальных и невизуальных системах фототрансдукции и фотоизомеразах. Здесь мы описываем разнообразие этих белков и их роль в фототрансдукции. Затем мы исследуем молекулярные свойства опсинов, анализируя сайт-направленных мутантов, стратегически разработанный филогенетическим сравнением. Этот сайт-направленный подход мутантов заставил нас идентифицировать многие ключевые особенности эволюции молекул фоторецепторов. В частности, мы обсудим эволюцию противоиона, снижение связывания агонистов с рецептором и молекулярные свойства, которые характеризуют оппоненты палочек, отличные от колбочек опсинов. Мы покажем, как достижения в молекулярной биологии и биофизике дали нам представление о том, как эволюция работает на молекулярном уровне.[2]
Меланопсин[править | править код]

Меланопсин — фотопигмент, один из опсинов, непосредственно участвует в зрительном процессе, регуляции циркадных ритмов; он находится в специализированных фоточувствительных ганглиальных клетках сетчатки глаза, в коже и мозговых тканях живонтных. Этот зрительный пигмент (фотопигмент) был обнаружен в ганглиальных клетках ipRGC сетчатки глаза млекопитающих.[4]
Мелаопсин принимает участие в режиме «сна-бодрствования», супрессии эпифизального мелатонина у человека; участвует в зрачковом рефлексе, в формировании зрительных образов. [5][6]
- Рис. 2. Melanopsin ген. (a) Выведена последовательность аминокислоты и предсказана вторичная структура меланопсина. Заштрихованная область указывает трансмембранные области. (b) Филогенетическое дерево, сравнивающее меланопсин с представительными опсинами (opsins) позвоночных и нехарактерных разновидностей (L, чувствительных к "длинной длине волны" opsin; M1, синяя-подобная — "средняя длина волны" opsin; M2, зелено-подобная — "средняя длина волны" opsin; P, шишковидныйopsin; Rh, rhodopsin; S, "короткая длина волны, чувствительны все клетки" от цыпленка; VA, позвоночное животное, древнее opsin-от Атлантический лосось). (c) Hydropathy анализ для вторичного предсказания структуры. Приспособленный от Provencio и др. 1998.
Уникальная способность клеток ipRGCs, чтобы ответить на свет, происходит только за счёт выделенного фотопигмента меланопсина (melanopsin). Первоначально клонированный от лягушки кожный melanophores, melanopsin ген (OPN4) имеется orthologs у многих млекопитающих разновидностях, включая мышей, обезьян и людей (Provencio, Родригес и др. 2000). Анализ гидрофобной последовательности аминокислоты melanospin предсказывает, что 7-трансмембранная структура, обычная во всех G-Белках , которая объединила рецепторы (рис. 2a, 2c) (Provencio, Jiang и др. 1998). Мкланопсин универсален, он больше похож на беспозвоночный rhabdomeric opsins (r-opsins), чем ресничный opsins разновидностей позвоночных (c-opsins), при чём он больше, в качестве меланопсина может сигнализировать о свете посредством различных механизмов, чем используемые позвоночными палочками и колбочками фотопигменты (рис. 2b) (Provencio, Jiang и др. 1998).

- Рис. 3. Свидетельство меланопсина — фотопигмента фоторецептора ipRGC. Где:
- (a)Трансфекция клеток HEK293 (зеленое крайне левое изображение) с melanopsin (красное среднее изображение, сверхположенные красные и зеленые изображения в далекой правильной группе) делает их фоточувствительными (крайне левый след). Средства управления Untransfected (далекие правильные следы) не показали такого ответа, чтобы осветить в различном intensities.
- (b) клетки нервного узла retrolabeled от SCN в мышах с одной копией melanopsin гена (главный след, швабра +/-) имеют здравые свойственные легкие ответы, тогда как помеченные клетки нервного узла от мышей, полностью испытывающих недостаток melanopsin, не показывают никакой свойственной фоточувствительности, чтобы осветить (швабра-/-следоснования). Вставка в ответе показов следа основания, чтобы направить инъекцию потока, показывая помеченные клетки от швабры-/-здоровой мыши. Приспособленная Лукасом и др. 2003 и Qui и др. 2005.
Т.о., последние исследования меланопсина (см. рис. 2,3) (даже на генетическом уровне) исключают существующие сомнения, предположения о главной функции фотопигмента меланопсина. Его участие в формировании циркадных ритмов и в зрачковом рефлексе — это доказанный факт. [Замечание необходимое].
Опсины и фоторецепторы[править | править код]
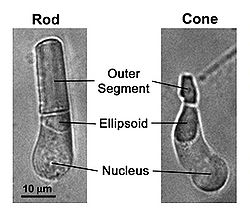
Формирование оптического изображение в процессе зрения у позвоночных животных связано с находящимися к сетчатке глаза колбочек (cone) и палочек (rod). Палочки продолжают работать при очень слабых уровнях освещения т. н. сумеречное зрение. Они чрезвычайно чувствительны и могут сигнализировать о поглощении одиночных фотонов. Колбочки намного менее чувствительны свету, чем палочки. Они учавствуют в цветном зрении при достаточно ярком (дневном) свете (иллюстрация 1).
- Рис. 1. Светлопольные изображения фоторецепторов (палочки и колбочки), выделеных из сетчатки саламандры. Фототрансдукция имеет место во внешней доле, в то время как митохондрии плотно упакованы в эллипсоиде.
В последние десятилетия получены новые результаты при исследованиях при микроскопии с большей разрешающей способностью, на живых клеткак, особенно на флюоресцентных микроскопах, когда полученная трёхмерная цветная информация клеток на молекулярном уровне раскрывает ранее только предполагаемые вопросы, например, цветного зрения, важных процессов фототрансдукции сигналов. С конца 1970-х гг. использовались экспериментальные методы введения электрода в сетчатку, для записи потенциалов (Baylor и др., 1979a). Фоторецепторы земноводных млекопитающих (включая приматов) могут быть исследованы этим методом. Бычья сетчатка раньше была частым объектом в исследованиях из-за изобилия доступной ткани. Позже мышь стала более лучшей моделью для исследования с использованием появившихся генных методов. В сочетании с электрофизиологическими методами, опыты на мышах с определённым геномом дают более точные результаты для объяснения функции ключевых белков фототрансдукции в естественных условиях, что на большом объеме новой информации дали возможность установить ранее предполагаемые принципы, лежащие в основе фототрансдукции сигнала в естественных условиях, увеличения, восстановления и адаптации фотоответов палочка/колбочка (Таблица 1, рис. 2,3).
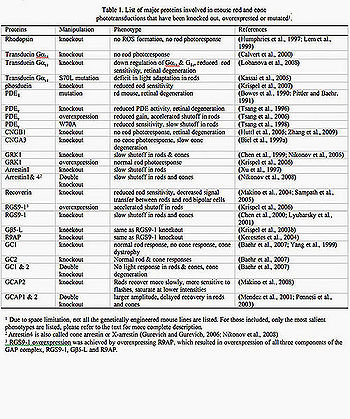
Таблица 1. Список основных белков, вовлеченных фототрансдукцию в палочках и колбочках мыши, которые были утеряны, или мутировали 1) из-за высокого ограничения, но не все генетически проектируемые линии мыши перечислены. Для включенных только перечислены самые существенные фенотипы (в тексте дано более полное описание). 2) Аррестин4 также называют колбочковым аррестином, (X-arrestin) (Gurevich и Gurevich, 2006; Никонов и др., 2008) Аррестин — белок сетчатки, контролирующий светочувствительность родопсина путем связывания с ним; в геноме человека ген, кодирующий аррестин, локализован на участке q24-37 хромосомы 2.
Опсины и зрительные пигменты[править | править код]
Опсины и другие зрительные пигменты, найденные в клетках фоторецепторов в сетчатках глаз. Опсин (на базе G-белков) образован в виде связки из семи трансмембранных альфа-спиралей, связанных шестью петлями. В клетках палочек молекулы опсинов (род-опсинов) вложены в мембраны дисков, которые размещаются полностью в клетке. «Голова» N-конечной-остановки молекулы простирается внутрь диска, а «хвост» с C-радикалом простирается в цитоплазме клетки. В клетках колбочки (c кон-опсинами)[10] диски определены плазменной мембраной клетки так, что голова N-конечной-остановки простирается вне клетки. Опсины сетчатки глаза ковалентно связаны с лизином на трансмембранной спирали, самой близкой C-конечной-остановки белка через Шиффовы основания. Формирование изменений Шиффова основания вовлекает удаление атома кислорода от относящегося к сетчатке глаза и двух водородных атомов от свободной группы аминокислоты лизина, давая H2O. Ретинилиден — двухосновная группа, сформированная так, что удаляет атом кислорода относящегося к сетчатке глаза, и потому опсины назвали ретинилиденовыми (retinylidene) белками. Бычий родопсин содержит 348 аминокислотных остатков. Соответствующий хромофор сетчатки глаза связывается с Lys296.
Опсины исключительно часто встречается в сетчатке глаза млекопитающих, у других групп животных дополнительно были найдены четыре хромофора с близкими свойствами. Это: (3,4)-дидегидроретиналь, (3R) — 3-гидроксиретиналь, (3S) — 3-гидроксиретиналь, и (4R) — 4-гидроксиретиналь. Много рыб и амфибий, используют также хромофор дегидроретиналь — (3,4)-дидегидроретиналь. У всех насекомых при исследовании выявлены энантиомер R 3-hydroxyretinal, за исключением хромофора dipteran, как у Cyclorrhapha, так называемых более крупных мух. Энантиомер R должен ожидаться, если 3-hydroxyretinal произведен непосредственно от каротиноидов-ксантофилов. Cyclorrhaphans, включая Дрозофилу, использование (3S) — 3-hydroxyretinal.[11][12] Кальмар светлячка, как находили, использовал (4R) — 4-h}droxyretinal.
Классификация опсинов[править | править код]
Общие cведения о химии опсинов[править | править код]
Большинство опсинов — ретиноиды. Существует множество вариантов белков-опсинов; в частности, они различны у разных видов животных. Некоторые из них приведены в следующей таблице.
| Ретиналь | Тип опсина | Пигмент | Длина волны света с макс. поглощением λMax, nm | Примеры применения |
|---|---|---|---|---|
| 11-cis-Retinal | Скотопсин | Родопсин (версия Миг) | 500 | Человек, позвоночные, членистоногие, моллюски |
| 11-cis-Retinal | UV-Фотопсин | UV-Йодопсин (версия Миг) (ультрафиолетовый) | 340 | Приматы, обезьяны, птицы |
| 11-cis-Retinal | S-Фотопсин | S-Йодопсин (версия Миг) (синий) dthcbz Vbu | 430 | Affen, человек, приматы |
| 11-cis-Retinal | M-Photopsin | M-Йодопсин (версия Миг) (зелёный) | 535 | человек, приматы |
| 11-cis-Retinal | L-Photopsin | L-Йодопсин (версия Миг) (красный) | 565 | Altweltaffen, приматы старого мира |
| 11-cis-Retinal | XL-Photopsin | XL-Iodopsin | 620 | Vögel, птицы |
| 3,4-Dehydro-11-cis-Retinal | Skotopsin | Порфиропсин | 520 | Амфибии, пресноводные рыбы |
| 3,4-Dehydro-11-cis-Retinal | UV-Photopsin | UV-Цианопсин | 360 | |
| 3,4-Dehydro-11-cis-Retinal | S-Photopsin | S-Cyanopsin | 420 | |
| 3,4-Dehydro-11-cis-Retinal | M-Photopsin | M-Cyanopsin | 530 | |
| 3,4-Dehydro-11-cis-Retinal | L-Photopsin | L-Cyanopsin | 580 | |
| 3,4-Dehydro-11-cis-Retinal | XL-Photopsin | XL-Cyanopsin | 620 | |
| 9-cis-Retinal | Skotopsin | Iso-Rhodopsin | 485 | |
| 9-cis-Retinal | Photopsin | Iso-Iodopsin | 515 | |
| 3,4-Dehydro-9-cis-retinal | Skotopsin | Iso-Porphyropsin | 510 | |
| 3,4-Dehydro-9-cis-retinal | Photopsin | Iso-Cyanopsin | 575 | |
| 13-cis-Retinal | Bakterien-Opsin | Bakteriorhodopsin, «Halorhodopsin» | 560 | Halobakterien (lichtgetriebene Protonenpumpe, siehe (Галобактерии, управляемые светом протонного насоса (см. (Хемиосмотическая связь)) |
| Melanopsin - Меланопсин (версия Миг) (UV, синий) | 485 | Человек, ганглиозные клеток сетчатки глаза ipRGC |
Опсины животных[править | править код]
[13].
└─o
├─o Меланопсины / Опсины, связанные с Gq
└─o
├─o
│ ├─o Энцефалопсины / tmt-опсины
│ │
│ └─o Опсины позвоночных (зрительные и не связанные со зрительным восприятием)
└─o
├─o Опсины, связанные с Go
└─o
├─o Нейропсины
└─o
├─o Перопсины
│
└─o Фотоизомеразы
Опсины позвоночных — нейропсины[править | править код]
[14].
└─o Пигменты древних позвоночных
├─o
│ ├─o Пигменты группы P
│ │
│ └─o Пигменты группы M/LWS
└─o
├─o Пигменты группы SWS1
└─o
├─o Пигменты группы SWS2
└─o
├─o Пигменты группы RH2
│
└─o Пигменты группы RH1
Следующие типы опсинов идентифицированы в тканях млекопитающих. Невзирая на некоторое генетическое сходство этих соединений и изомеров, их функции до конца не установлены.[15][16]
| Название | Ген | Примечания |
|---|---|---|
| Меланопсин | OPN4 | best studied novel opsin involved in circadian rhythms and pupillary reflex |
| Пинопсин (Pineal Opsin - Pinopsin)[17] | wide range of expression in the brain, most notably in the pineal region | |
| Опсин древних позвоночных (Vertebrate Ancient (VA) opsin)[18] | имеет 3 изоформы: короткую VA short (VAS), среднюю VA medium (VAM), и длинную VA long (VAL). Экспрессируется во внутренней сетчатке, в горизонтальных и амакринных клетках | |
| Парапинопсин (Parapinopsin (PP) Opsin) [19] | ||
| Несетчаточный (экстраокулярный) родопсин-подобный опсин (Rhodopsin-Like Opsins, Exo-Rh)[20] | Родопсин-подобный белок | |
| Энцефалопсин (Панопсин) | OPN3 | originally found in human and mice tissue with a very wide range of expression (brain, testes, heart, liver, kidney, skeletal muscle, lung, pancreas and retina) |
| Teleost Multiple Tissue (TMT) Opsin[21] | Teleost fish opsin with a wide range of expression | |
| Перопсин (Peropsin) «Retinal pigment epithelium-derived rhodopsin homolog» | RRH | expressed in the retinal pigment epithelium (RPE) cells |
| Retinal G protein coupled receptor | RGR | expressed in the retinal pigment epithelium (RPE) and Müller cells |
| Нейропсин | OPN5 |
Опсины первого и второго рода[править | править код]
Классифицируют два типа опсинов — первого и второго типов. Сходство в их структуре и функции указывает на их конвергентное происхождение у бактерии и животных.[22]
Опсины прокариот первого типа[править | править код]
Опсины прокариот имеют семь трансмембранных доменов, сходные по структуре с рецепторами, связанными с G-белками у эукариот. Несмотря на определённое сходство их строения, нет никаких подтверждений того, что они имеют эволюционное сходство; по-видимому, эти белки эволюционировали независимо друг от друга.[22]
Некоторые бактерии фиксируют углерод без участия хлорофилла, используя для этого опсины первого типа (протеородопсины, галородопсины и бактериородопсины). Галобактерии используют фоточувствительные родопсины в процессах фототаксиса, в этом процессе участвуют, связанные с плазматическими мембранами, белки системы передачи сигнала, не имеющие отношения к G-белкам.[23]
Группы опсинов второго типа[править | править код]
Два семейства опсинов позвоночных классифицируют по различиям в экспрессии и эволюционной истории. Родопсины, которые участвуют в сумеречном зрении, являются высокочувствительными к свету опсинами, и располагаются в палочках сетчатки, но с относительно невысокой плотностью, не обеспечивающей достаточной разрешающий способности глаза. Опсины колбочек расположены в клетках колбочек сетчатки, они участвуют в цветном зрении, и имеют меньшую светочувствительность, чем опсины палочек. Зато их плотность в сетчатке выше, поэтому они обеспечивают более высокую разрешающую способность дневного зрения. Опсины колбочек также классифицируют по длине волн максимального поглощения света. Также для классификации часто сравнивают аминокислотные последовательности опсинов разных групп.
Оба подхода позволяют выделить четыре основных группы опсинов.[24] У человека представлен следующий набор зрительных белков:
- Родопсин (Rh1, OPN2, RHO) — экспрессируется в палочках, участвует в ночном зрении
- Четыре типа опсинов колбочек (фотопсины) — экспрессируются в колбочках, участвуют в цветном зрении
- Чувствительные в области длинных волн (Long Wavelength Sensitive, LWS, OPN1LW) опсины — λmax в красном диапазоне
- Чувствительные в области волн средней длины (Middle Wavelength Sensitive, RH2 или MWS) опсины — λmax в зеленой части спектра
- Чувствительные в области коротких волн 2 (SWS2) опсины — λmax в синем диапазоне
- Чувствительные в области коротких волн 1 (SWS1) опсины — λmax в фиолетовой и ультрафиолетовой части диапазона
Для последних трех опсинов у человека известны связанные с ними гены: OPN1MW, OPN1MW2, и OPN1SW.
Разные животные могут обладать различными наборами фоторецепторных белков, спектры поглощения которых отличаются от спектров поглощения белков свойственных человеку. В связи с этим восприятие света и цвета у человека и животных, должно отличается. Некоторые насекомые, например, могут видеть и в ультрафиолетовом диапазоне, в то время, как у других живых существ чувствительность фоторецепторов может быть сдвинута в инфракрасную область. Считается, что животные с одним типом опсинов видят окружающий мир монохромным (черно-белым).
Структура и функции[править | править код]
Опсины ковалентно связаны с ретиналем — альдегидной формой витамина А, связывание идет через конденсацию альдегидной группы ретиналя с ε-аминогруппой остатка лизина в седьмой трансмембранной альфа-спирали с образованием основания Шиффа. У позвоночных хромофор находится в цис-форме. Поглощение фотона приводит к изменению конформации в транс-состояние. Фотоизомеризация вызывает конформационные изменения в G-белке опсине и активирует каскад фототрансдукции.
Опсины содержат семь трансмембранных альфа-спиральных доменов, соединенных тремя внеклеточными и тремя цитоплазматическими петлями. Многие остатки аминокислот являются эволюционно консервативными между разными группами опсинов.[25] Остаток Lys296 консервативен во всех известных опсинах и служит сайтом связывания основания Шиффа с хромофором.
Механизмы обонятельных процессов с участием опсинов[править | править код]
Механизмы вомероназального восприятия с участием опсинов[править | править код]
Механизмы циркадных ритмов с участием опсинов[править | править код]
Механизмы зрительных процессов с участием опсинов[править | править код]
Сначала даётся краткое описание структуры и развития фоторецепторов мыши, сопровождаемых резюме недавних исследований фототрансдукции палочки с акцентом на информацию, подбираемой от образцов мыши. В конце, будет упомянут недавний прогресс в обучающихся колбочках мыши.
Структура палочек и колбочек[править | править код]
Палочки составляют ~97 % фоторецепторов сетчатки глаза мыши, колбочки — остальное (Картер-Доусон и LaVail, 1979). Методика измерений параметров клеток фоторецепторов мыши как и фоторецепторов приматов аналогична (Стол 2 и иллюстрация 2) . Внешняя доля — приблизительно в диаметре 1.4мкм и 24мкм в длину для палочек, и, соответственно, приблизительно 1.2мкм и 13мкм для колбочек. Эти величины являются значительно меньшими, чем у фоторецепторов земноводных (иллюстрация 1), которые объясняют давнюю пользу физиологов для исследований последних.

- Таблица 2. Физические измерения внешней доли палочек мыши и колбочек Саламандры, а фоторецепторы примата включены для сравнения.
Палочки и колбочки имеют четыре первичных структурных/функциональных областей: внешняя доля, внутренняя доля, тело ячейки и синаптический терминал. Внешняя доля связана с внутренней долей через тонкую соединительную ресницу. Внешняя доля является заполненной плотным прозрачным веществом мембранных дисков (иллюстрации 2 и 3), разделённой промежутками в приблизительно в 28 нм. Диски несут визуальный пигмент (rhodopsin в палочках и разновидности пигментов колбочки в колбочках) и других компонентах трансдукции или как трансмембранные или периферийные мембранные белки (иллюстрация 3). Визуальный фотопигмент — самый насыщенный белок во внешней доле (мембране). Важность визуального пигмента как главного структурного компонента демонстрируется у мыши rhodopsin-нокаута, палочке, внешние доли которой не в состоянии сформироваться (Humphries и др., 1997; Лем и др., 1999). Фоторецепторы палочки этой мыши — выродившийся сопровождаемый представитель колбочек. Упаковочная плотность молекул пигмента на дисках необычно однородна поперек различных позвоночных разновидностей, содержашихся на площади ~25000 мм², соответствуя концентрации ~ 3mM (Harosi, 1975). Общее количество молекул пигмента во внешней доле может таким образом быть вычислено примерно от ее объема конверта. Плотный стек дисков очень увеличивает вероятность захвата фотона. Интересное различие между палочками и колбочками — это то, что диски палочки(за исключением возникающих дисков в основе внешней доли) полностью усвоены и поэтому физически отдельные от плазменной мембраны, тогда как диски колбочки остаются свёрнутыми плазменной мембраной. Открытые диски колбочки предлагают намного большую поверхностную область для быстрых потоков веществ между внешностью клетки и интерьером, по типу передачи хромофора для регенерации фотопигмента и быстрой динамики кальция в течение световой адаптации.

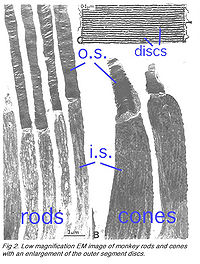
- Рис. 2. Слабое усиление изображений (малая светочувствительность) палочек и колбочек обезьяны с расширением внешних дисков (мембран) доли.
- Рис.3. Схематическая диаграмма rhodopsin во внешних дисках (мембран) доли.
Внутренняя доля фоторецепторов содержит endoplasmic сеточку и аппарат Golgi. Это также упаковано mitochondria, близко, смежно с внешней долей (иллюстрации 2 и 3), чтобы обеспечить высокий спрос на метаболическую энергию, связанную с фототрансдукцией. Все белки, предназначенные для внешней доли, должны пройти через узкую зону соединительной ресницы между внешним и внутренними долями.
Синаптический терминал передает световой сигнал к нейронам второго уровня в сетчатке: к биполярным и горизонтальным клеткам. В темноте есть устойчивый внутренний поток («темный поток») через проводимость катиона на мембране внешней доли (Hagins и др., 1970), деполяризуя палочку или колбочку и поддерживая устойчивый синаптический выпуск глутамата. Свет закрывает эту проводимость катиона («светочувствительная» проводимость, состоя из cGMP-gated каналов) служит, чтобы остановить темный поток и произвести мембранную гиперполяризацию как ответ. Эта гиперполяризация уменьшает или заканчивает темный глутаматный выпуск. Сигнал далее обработывается другими нейронами в сетчатке прежде, чем передаётся в высшие отделы зрительных центров в мозге.
Зрительные пигменты палочек и колбочек[править | править код]
Зрительные пигменты палочек и колбочек мыши[править | править код]
Некоторые исследователи до сих пор ошибочно считают, что наличие определённого числа опсинов в тканях сетчатки должно означать и существование такого же числа колбочек (видимо исходя из предположения: одна колбочка — один опсин). Подтверждения этой догадке так и не получено. Наоборот доказано, что в колбочке одновременно может находится несколько различных опсинов входящих в состав светочувствительных пигментов. (1964)[29]
Однако, проводятся исследования механизмов цветовосприятия, связанных с существованием различных типов колбочек с различными пигментами, чувствительными к областям спектра S, M., L . Пример такого подхода прослеживается и в работе, посвящённой исследованию сетчатки глаза мыши.
В сетчатке мыши обнаружены единственный пигмент палочки, rhodopsin, и два пигмента колбочек. Авторы предполагают, что пигменты чувствительные к коротковолновой области находятся только в S-(синих) колбочках, а пигменты чувствительные к длинноволновой оласти соответственно в M.-(зелёных) колбочках, с максимальной спектральной чувствительностью в 360 нм и 508 нм, соответственно. Мышь необычна в том индивидуальном составе -S и -М. пигментов колбочек, когда уровень пигмента М колбочки имеет градиент уменьшения от спинной до брюшной части сетчатки (Applebury и др., 2000).
Мышь-rhodopsin и пигменты колбочек принадлежит семье высшего качества соединенных рецепторов Белка г (GPCRs). С высокой разрешающей способностью (2.8 Å) была определена трехмерная структура банка основания бычьего rhodopsin в 2000 Palczewski и др. (иллюстрация 9b) (Palczewski и др., 2000; Stenkamp и др. 2002). Будущий вызов должен решить структуру пигментов колбочки, которые намного более непостоянны, чем единственный пигмент палочки родопсин (версия Миг) (rhodopsin).

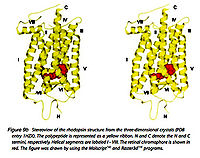
- Иллюстрация 9. Структурная модель бычьего rhodopsin, показ семи трансмембранных компонентов и участка приложения в сетчатке глаза. Семь ТМ helices показывают пронумерованные серые коробки, и β-strands — берега показывают стрелки. Соответствующие диапазоны остатка этого ТМ helices следующие: я, 35-60; II, 71-100; III, 107—137; IV, 151—173; V, 200—225; VI, 247—277; VII, 286—306; VIII, 310—324. Расплющенная линия указывает двусернистое обязательство C110-C187, расположенное в интерфейсе между областями EC и ТМ. Переизданный от (Rader и др., 2004)
- Иллюстрация 9b. Пара стерео кристаллической структуры rhodopsin. От Stenkamp и др. 2002.
Исследования в области идентификации фоторецепторных опсинов[править | править код]
Недавно были опубликованы работы в которых были предложены возможные механизмы трансдукции биосигнала колбочки сетчатки рыбы как образца (Kawamura и др., 2004; Shimauchi-Matsukawa и др., 2005; Tachibanaki и др., 2005; Tachibanaki и др., 2001; Wada и др., 2006). Однако, несмотря на изучение фототрансдукции палочки за счёт комбинации генетики мыши и микро электродов, позволяющих делать запись нервных импульсов на примерах сетчатки мыши, была до недавнего времени ограничена исследованиями ЭРГА. Это связано с тем, что процент колбочек в сетчатке мал (~3 %) и недолговечность внешней доли (мембраны) (САЛАТ РОМЭН).
Это препятствие было, наконец, преодолено Pugh и коллегами (Никонов и др., 2005; Никонов и др., 2006). Обычную регистрацию пипетки всасывания, которая вовлекает попадание ПЗУ в пипетку всасывания («РОТ в»), и при этом не допускался более хрупкий «САЛАТ РОМЭН», который мог обеспечивать условия хорошего вовлечения ПЗУ в пипетку всасывания . Вместо этого Pugh и коллеги тянули часть внутренней доли («РОТ») фоторецептора колбочки, относящейся к сетчатке глаза мембранной пластины, позволяя длинную, устойчивую регистрацию. Предварительно показано, что та же самая информация могла быть получена, делая запись или от внешней или от внутренней доли земноводных палочек и колбочек (Yau и др., 1981) как ожидается от природы циркулирующего потока.
Чтобы преодолевать трудность идентификации колбочек с ~3 % в сетчатке мыши, Pugh и коллеги использовали три различных вида мышей.
- Первый вид испытывает недостаток в нервном лейциновом факторе транскрипции застежки — молнии (Nrl) (Mears и др., 2001), который решительно изменяет судьбу клетки фоторецепторов палочки, превращая их в подобные колбочке фоторецепторы (Даньеле и др., 2005; Никонов и др., 2005).
- Второй EGFP экспрессов в кодбочках мыши, который облегчает/проверяет их идентификацию (Fei и Hughes, 2001).
- Третий испытывает недостаток в палочке transducin α-subunit (gnat1-/-), который блокирует фототрансдукцию прута (Calvert и др., 2000).
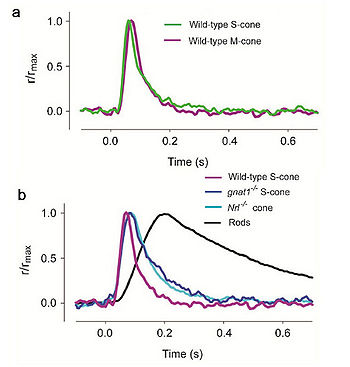
- Иллюстрация 16. Ответы вспышки фоторецепторов кобочек мыши от различных генотипов. a. Сравнение среднего ответа Булочек (Колбочек-S) при вспышках с 361 нм и М. колбочек при вспышках с 510 нм (b). Сравнение средних ответов вспышки на вспышки с 361 нм дикого типа S-колбочек, gnat1-/- или Nrl-/- колбочки, и палочки, зарегистрированные под тем же самым «РТОМ» условии. Каждый след измерен с одиночной вспышкой в его пике. Данные от рис. 4E и F (Никонов и др., 2006) опубликованы с разрешением из Университетской Прессы Rockefeller.
В случае линии мыши EGFP, фоновый свет подбирался таким, чтобы подавить ответ палочки, и чтобы ответ колбочки мог быть изолирован. В результате ответ колбочки немного приспособлен подбором света, и поэтому был немного более быстр и меньшим для данной интенсивности испытательной вспышки, чем это от gnat1-/- или Nrl-/- колбочки. Когда этот фактор был учтен, легкие свойства ответа колбочек мыши, зарегистрированных от трех mouselines, очень подобны и как ожидалось они относятся к колбочкам млекопитающих (иллюстрация 16, Стол 3) (Никонов и др., 2006). Видно, что среди этих особенностей — то, что колбочки мыши намного более терпимы, чем палочки мыши к обесцвеченному пигменту. Темный поток света (меньшая освещённость) воспринимается более существенно в обоих колбочках типа S и M. после воздействия сильных лучей вспышек, которые отбеливают существенную фракцию фотопигмента. Однако, одно обнаруженное удивление состоит в том, что инактивация М. пигмента более задержана, чем от от пигмента S в отсутствии GRK1, предлагая существование GRK1-независимого механизма инактивации для пигмента S. Nrl-/- колбочки отличаются от дикого типа в определенных отношениях. Их внешние доли короче, более беспорядочны и подвергаются медленному вырождению (Даньеле и др., 2005). Кроме того, в отличие от дикого типа, Nrl-/- колбочки выражают намного более высокий процент активности от S-opsin. Таким образом, трансгенные мыши, выражающие EGFP в их колбочках и gnat1-/- мыши лучше, чем Nrl-/- мыши для того, чтобы изучать физиологию колбочки. Таким образом получена зависимость активности трансгенных колбочек и диких в зависимости от разновидности пигмента кон-опсина, и следовательно имеется связь между видом колбочек S,M,L и видом пигмента в каждой из них! (Необходимое замечание).

- Таблица 3. Динамика и параметры чувствительности палочек и колбочек мыши 1.
Индентифткация разновидностей йодопсина[править | править код]
У человека идентифицировано три вида фотопигментов колбочек йодопсина (фотопсина):
- 560 nm: rot-sensitives L-Iodopsin mit L-Photopsin, Шаблон:UniProt. Defekte am OPN1LW-Gen sind die Ursache der Protanopie (колбочки сетчатки глаза с разновидностью йдопсина красного цвета).
- 530 nm: grün-sensitives M-Iodopsin mit M-Photopsin, Шаблон:UniProt. Defekte am OPN1MW-Gen sind die Ursache der Deuteranopie (колбочки сетчатки глаза с разновидностью йдопсина зелёного цвета).
- 420 nm: blau-sensitives S-Iodopsin mit S-Photopsin, Шаблон:UniProt. Defekte am OPN1SW-Gen sind die Ursache der Tritanopie (колбочки сетчатки глаза с разновидностью йдопсина синего цвета).
Пока известно, что йодопсин находящийся в колбочках глаза, включает в себя такие фотопигменты, как хлоролаб и эритролаб; первый из них поглощает лучи, соответствующие жёлто-зелёной, а второй жёлто-красной частям спектра.
Идентификация фотопигмента йодопсина — цианолаба[править | править код]
Фотопигменты Опсины (версия Миг) — G-белки фотосинтеза и зрения.
Разновидность опсинов содержит четыре группы фотопигментов колбочек, участвующих в цветном зрении:
- Четыре типа опсинов колбочек (фотопсины) — экспрессируются в колбочках, участвующих в цветном зрении с общим названием йодопсины:
- Чувствительные в области длинных волн (Long Wavelength Sensitive, LWS, OPN1LW) опсины — λmax в красном диапазоне — это эритролаб, поглощающий жёлто-красные части спектра.
- Чувствительные в области волн средней длины (Middle Wavelength Sensitive, RH2 или MWS) опсины — λmax в зеленой части спектра — это хлоролаб, поглощающий лучи, соответствующие жёлто-зелёным частям спектра.
- Чувствительные в области коротких волн 2 (SWS2) опсины — λmax в синем диапазоне — это пока не открытые фотопигменты цианолаба;
- Чувствительные в области коротких волн 1 (SWS1) опсины — λmax в фиолетовой и ультрафиолетовой части диапазона — это пока не открытые фотопигменты цианолаба;
Таким образом, в области длинных и средних (красный и зелёный диапазон) волн фотопигменты колбочек обнаружены, а в области коротких волн предполагаемый фотопигмент цианолаб (версия Миг) (фотопигмент синих колбочек-S) пока не обнаружен, но индентифицирован.
Нахождение синих колбочек-S у приматов[править | править код]




В последние десятилетия при исследованиях фотопигментов фоторецепторов, особенно колбочек приматов, удалось доказать о наличии синих колбочек-S, которые содержат синий пигмент, то есть предполагаемый цианолаб. (См. Особенность работы S-колбочек (версия Миг)) Важно открытие синих колбочек-S, а сам пигмент с названием цианолаб будет также открыт.
- С позиций принципа трихроматизма получена:
- Идентификация спектральной чувствительности двух фотопигментов колбочек сетчатки глаза денситометрией Руштона (Руштон, 1963).
- Идентификация трех пигментов колбочек микроспектрометрией (Марки, Dobelle и MacNichol, 1964).
- Идентификация генетического кода для красных колбочек — L, зелёных колбочек — М. и синих колбочек — S (Nathans и другие, 1986a, b).
- Цвет (синий, зелёный, красный), соответствующий функциям.
- Изоляция фоторецепторов и измерение их физиологического repsonses как функция длины волны (Baylor и другие, 1984).
- Определены спектральные размеры чувствительности (Wald-Marre — фунуционирование спектральной чувствительности и функционирование « Турникетов» механизмов).
В итоге: получены снимки колбочек (см.рис.19,S), цветные графики трёх колбочек (см.рис.1), воспринимающих основные лучи КЗС — S,M,L, на которых видна графика точек синих лучей S колбочки-S, которые колбочка выделяет; показаны сами синие колбочки при исследованиях на живых клетках сетчатки как снятых на срезах, так и снятых в плане фокальной поверхности сетчатки. Визуально мы видим синие цветы в букете КЗС (см. рис.3). Т.е вопрос не открытого третьего фотопигмента йодопсина — цианолаба не означает, что нет синей колбочки и нет синего фотопигмента цианолаба.
Смотри также[править | править код]
- Фотосинтез
- Оптогенетика
- Палочки сетчатки глаза (версия Миг)
- Колбочки сетчатки глаза (версия Миг)
- Лаборатория Р.Е.Марка (версия Миг)
- Основные цвета (версия Миг)
Литература[править | править код]
Примечания[править | править код]
- ↑ http://humbio.ru/humbio/ssb/001181d1.htm
- ↑ http://rstb.royalsocietypublishing.org/content/364/1531/2881
- ↑ http://webvision.med.utah.edu/Melanopsin.html
- ↑ http://c3012152.cdn.cloudfiles.rackspacecloud.com/110119eye.pdf
- ↑ Provencio I, Jiang G, De Grip W, Hayes W, Rollag M (1998). "Melanopsin: An opsin in melanophores, brain, and eye" (HTML: full text). Proc Natl Acad Sci U S A 95 (1): 340–5. DOI:10.1073/pnas.95.1.340. PMID 9419377.
- ↑ http://c3012152.cdn.cloudfiles.rackspacecloud.com/110119eye.pdf
- ↑ http://webvision.med.utah.edu/Melanopsin.html
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://humbio.ru/humbio/ssb/001181d1.htm
- ↑ Seki, Takaharu; Isono, Kunio; Ito, Masayoshi; Katsupa, Yuko (1994). «Flies in the Group Cyclorrhapha Use (3S)-3-Hydroxyretinal as a Unique Visual Pigment Chromophore». European Journal of Biochemistry (Wiley) 226 (2): 691—696. doi:10.1111/j.1432-1033.1994.tb20097.x. PMID 8001586
- ↑ Seki, Takaharu; Isono, Kunio; Ozaki, Kaoru; Tsukahara, Yasuo; Shibata-Katsuta, Yuko; Ito, Masayoshi; Irie, Toshiaki; Katagiri, Masanao (1998). «The metabolic pathway of visual pigment chromophore formation in Drosophila melanogaster: All-trans (3S)-3-hydroxyretinal is formed from all-trans retinal via (3R)-3-hydroxyretinal in the dark». European Journal
- ↑ Шаблон:Article
- ↑ Шаблон:Article
- ↑ http://www.nature.com/nmeth/index.html
- ↑ http://vse-pro-geny.ru/ru_dictionary_item_95_1_%D0%9E%D0%BF%D1%82%D0%BE%D0%B3%D0%B5%D0%BD%D0%B5%D1%82%D0%B8%D0%BA%D0%B0.html
- ↑ Okano T, Yoshizawa T, Fukada Y (1994). "Pinopsin is a chicken pineal photoreceptive molecule". Nature 372 (6501): 94–7. DOI:10.1038/372094a0. PMID 7969427.
- ↑ Philp AR, Garcia-Fernandez JM, Soni BG, Lucas RJ, Bellingham J, Foster RG (2000). "Vertebrate ancient (VA) opsin and extraretinal photoreception in the Atlantic salmon (Salmo salar)". J. Exp. Biol. 203 (Pt 12): 1925–36. PMID 10821749.
- ↑ Blackshaw S, Snyder SH (1997). "Parapinopsin, a novel catfish opsin localized to the parapineal organ, defines a new gene family". J. Neurosci. 17 (21): 8083–92. PMID 9334384.
- ↑ Mano H, Kojima D, Fukada Y (1999). "Exo-rhodopsin: a novel rhodopsin expressed in the zebrafish pineal gland". Brain Res. Mol. Brain Res. 73 (1-2): 110–8. DOI:10.1016/S0169-328X(99)00242-9. PMID 10581404.
- ↑ Moutsaki P, Whitmore D, Bellingham J, Sakamoto K, David-Gray ZK, Foster RG (2003). "Teleost multiple tissue (tmt) opsin: a candidate photopigment regulating the peripheral clocks of zebrafish?". Brain Res. Mol. Brain Res. 112 (1-2): 135–45. DOI:10.1016/S0169-328X(03)00059-7. PMID 12670711.
- ↑ а б Fernald, Russell D. (September 2006), "Casting a Genetic Light on the Evolution of Eyes", Science 313 (5795): 1914–1918, PMID 17008522, doi:10.1126/science.1127889
- ↑ Römpler H, Stäubert C, Thor D, Schulz A, Hofreiter M, Schöneberg T (February 2007), "G protein-coupled time travel: evolutionary aspects of GPCR research", Molecular Interventions 7 (1): 17–25, PMID 17339603, doi:10.1124/mi.7.1.5
- ↑ Terakita A (2005). "The Opsins". Genome Biology 213 (6(3)): 213. DOI:10.1186/gb-2005-6-3-213.
- ↑ Palczewski K et al (2000). "Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor". Science 289 (5480): 739–45. DOI:10.1126/science.289.5480.739. PMID 10926528.
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ Marks W. B., W. H. Dobelle, E. F. McNichol. 1964. Science, 143 : 1181.
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Concluding%20remarks
- ↑ http://webvision.med.utah.edu/book/part-viii-gabac-receptors/colo perception/
- ↑ "Seeing in color". Prometheus. Retrieved 8 сентября, 2012. Check date values in:
|accessdate=(help)
Внешние ссылки[править | править код]
- Review of opsins and current research: doi:10.1098/rstb.2009.0051
Вы можете подставить цитату вручную или с помощью бота. - Illustration — иллюстрации с сайта Baldwin-Wallace College
- MeSH Opsin